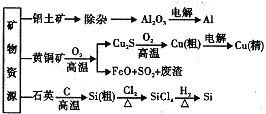
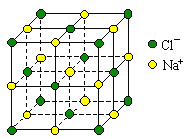
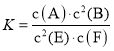题目内容
【题目】已知![]() 将硫酸铵完全分解后的气体通入过量
将硫酸铵完全分解后的气体通入过量![]() 溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是
溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是![]()
A.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:1
约为1:1
B.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:2
约为1:2
C.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:3
约为1:3
D.从溶液中逸出的气体只有![]() ,溶液中溶质只有
,溶液中溶质只有![]() 、
、![]()
【答案】A
【解析】
从溶液中逸出的气体无色、无味,该气体为![]() ,说明除了
,说明除了![]() 其它气体都参与反应,由
其它气体都参与反应,由![]() 、
、![]() 、
、![]() 、
、![]() 可知,1mol二氧化硫转化为1mol亚硫酸铵消耗氨气为2mol,1mol三氧化硫转化为硫酸铵消耗氨气2mol,若生成6mol氨气时,4mol氨气和
可知,1mol二氧化硫转化为1mol亚硫酸铵消耗氨气为2mol,1mol三氧化硫转化为硫酸铵消耗氨气2mol,若生成6mol氨气时,4mol氨气和![]() 反应生成亚硫酸铵,2mol氨气与1mol三氧化硫反应生成硫酸铵,得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余
反应生成亚硫酸铵,2mol氨气与1mol三氧化硫反应生成硫酸铵,得到的沉淀为1mol硫酸钡,2mol亚硫酸钡,剩余![]() 和1mol亚硫酸钡反应生成亚硫酸氢钡,最后得到沉淀为1mol硫酸钡、1mol亚硫酸钡,则
和1mol亚硫酸钡反应生成亚硫酸氢钡,最后得到沉淀为1mol硫酸钡、1mol亚硫酸钡,则![]() :
:![]() :1,溶液中溶质含
:1,溶液中溶质含![]() 、
、![]() ,
,
答案选A。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
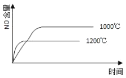
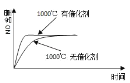
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
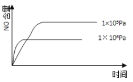
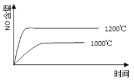
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。