题目内容
【题目】实验题
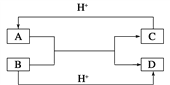
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
实验步骤 | 实验现象 | 实验结论及离子方程式 |
| 甲___________ 乙___________ | 离子方程式 甲___________ 乙___________ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
W | X | Y |
Z |
请回答下列问题:
①写出Z的原子结构示意图:__________________。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可) _____
编号 | 性质推测 | 化学方程式 |
示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
1 | ||
2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________。
【答案】 溶液由无色变为橙色 溶液由无色变为黄色 ![]()
![]() B 溴水
B 溴水 

![]() ··C··
··C··![]()
【解析】试题分析:(1)①氯气氧化性大于溴和碘,所以氯气能置换出溴和碘;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;③需要补充实验证明氧化性Br2>I2;(2)短周期元素X的最高正化合价是+5,说明X是ⅤA族元素,根据元素周期表,Y是ⅥA族元素,Y的单质可在空气中燃烧,所以Y是S元素,根据在元素周期表中的相对位置,W、X、Z分别是Si、P、Se。
解析:(1)①氯气氧化性大于溴和碘,所以氯气能置换出溴和碘,向溴化钠溶液中滴加氯水生成氯化钠和溴单质,现象是溶液由无色变为橙色,反应离子方程式是![]() ;向碘化钠溶液中滴加氯水生成氯化钠和碘单质,现象是溶液由无色变为黄色,反应离子方程式是
;向碘化钠溶液中滴加氯水生成氯化钠和碘单质,现象是溶液由无色变为黄色,反应离子方程式是![]() ;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;不能证明氧化性Br2>I2,故甲同学设计的实验方案部分合理,选B;要证明氧化性Br2>I2,需要向NaI溶液中滴加溴水,若溶液变为黄色,则证明氧化性Br2>I2,所以完成实验还需要的试剂是溴水;(2)根据以上分析,Y是S元素, W、X、Z分别是Si、P、Se。①Se的原子结构示意图:
;②向溴化钠溶液中滴加氯水证明氧化性Cl2>Br2、向碘化钠溶液中滴加氯水证明氧化性Cl2>I2;不能证明氧化性Br2>I2,故甲同学设计的实验方案部分合理,选B;要证明氧化性Br2>I2,需要向NaI溶液中滴加溴水,若溶液变为黄色,则证明氧化性Br2>I2,所以完成实验还需要的试剂是溴水;(2)根据以上分析,Y是S元素, W、X、Z分别是Si、P、Se。①Se的原子结构示意图: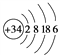 。
。
②Z是ⅥA族元素,最高价是+6价,H2ZO3中Z元素的化合价是+4,所以H2ZO3既有氧化性又有还原性、酸性,相应的化学方程式是
③化合物COS中,所有原子的最外层都满足8电子结构,与二氧化碳为等电子体,等电子体微粒的结构相似,COS的电子式是![]() 。
。

 名校课堂系列答案
名校课堂系列答案