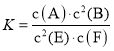题目内容
【题目】将10 g Fe2O3、SiO2、Al2O3的混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液的体积关系如图所示。下列叙述错误的是
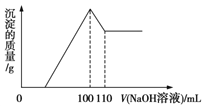
A.滤出的物质为SiO2
B.可求出x的值
C.可求出Al2O3的质量分数
D.可求出Fe2O3的质量分数
【答案】D
【解析】
A.二氧化硅与硫酸不反应,则滤出的物质为SiO2,A正确;
B.当加入NaOH100mL时沉淀为氢氧化铁和氢氧化铝,溶液溶质为硫酸钠,根据H2SO4-Na2SO4-2NaOH可知n(Na)=2n(H2SO4),可知x的值,B正确;
C.加入NaOH110mL时,氢氧化铝全部溶解,则根据Al(OH)3+NaOH=NaAlO2+2H2O可知Al2O3的质量分数,C正确;
D.由于滤液中过量的酸的量和沉淀的总质量未知,则不能确定氧化铁的质量,D错误;
答案选D。
【点晴】
明确物质的性质,注意根据图像判断各反应,根据反应方程式计算该题是解答的关键。注意掌握图像的答题技巧:①看面:弄清纵、横坐标的含义。②看线:弄清线的变化趋势,每条线都代表着一定的化学反应过程。③看点:弄清曲线上拐点的含义,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。曲线的拐点代表着一个反应过程的结束和开始。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
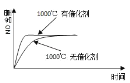
激活思维优加课堂系列答案【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
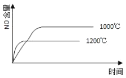
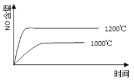
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
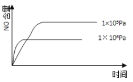
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。