题目内容
【题目】下列热化学式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3 kJmol﹣1
B.500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H=﹣38.6 kJmol﹣1
2NH3(g)△H=﹣38.6 kJmol﹣1
C.稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1
D.1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8 kJmol﹣1
【答案】C
【解析】解:A.甲烷的燃烧热为 890.3 kJmol﹣1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890.3 kJmol﹣1,故A错误;
B.合成氨为可逆反应,热化学方程式转化为完全转化时的能量变化,且焓变为负,则热化学方程式为:N2+3H2(g) ![]() 2NH3(g)△H<﹣38.6 kJmol﹣1,故B错误;
2NH3(g)△H<﹣38.6 kJmol﹣1,故B错误;
C.稀的强酸与强碱生成1molH2O(l)为中和热,则稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3 kJmol﹣1,故C正确;
D.物质的量与热量成正比,且燃烧反应的焓变为负,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=﹣285.8 kJmol﹣1,故D错误;
故选C.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

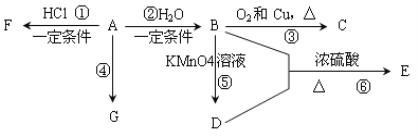
【题目】一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
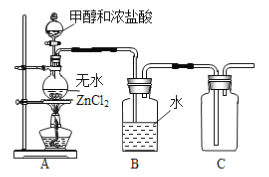
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为___________,如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____________。
②装置B的主要作用是____________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1 mL c1 mol·L-1 NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定,最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C—Cl | C—Br |
键能(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式______________。
②CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
③设计实验证明Ksp(AgCl)>Ksp(AgBr):___________(简要说明实验操作、现象和结论)。
【题目】如表列出了①~⑧八种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | |||||||
三 | ② | ③ | ④ | ⑤ | ⑦ | |||
四 | ⑥ | ⑧ |
请按要求回答下列问题:
(1)元素③的原子结构示意图是_________________________,以上元素的最高价氧化物形成的水化物酸性最强的是_______________________(填分子式)。
(2)②、③、⑦三种元素的原子形成的简单离子半径由大到小的顺序排列为_____________(用离子符号表示);②、③、⑥三种元索的最高价氧化物对应的水化物碱性由弱到强的顺序是__________________(用化学式表示)。
(3)向元素②的单质与水反应后的溶液中加入元素④的单质,发生反应的化学方程式为________________。
(4)用离子方程式证明⑦⑧两元素非金属性的强弱__________________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃