题目内容
【题目】一氯甲烷是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等。
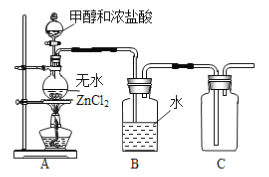
(1)某小组同学在实验室用如图所示装置模拟催化法制备和收集一氯甲烷。
①无水ZnCl2为催化剂,圆底烧瓶中发生反应的化学方程式为___________,如果实验时圆底烧瓶加热时间过长,最终在瓶底得到一种白色物质,该物质的化学式是____________。
②装置B的主要作用是____________。
③收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1 mL c1 mol·L-1 NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol·L-1盐酸标准液对吸收液进行返滴定,最终消耗V2 mL盐酸。则所收集CH3Cl的物质的量为________mol。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
(2)查阅资料可知:AgNO3的乙醇溶液可以检验CH3X中的卤素原子。相关数据如下表:
化学键 | C—Cl | C—Br |
键能(kJ·mol-1) | 330 | 276 |
化合物 | AgCl | AgBr |
Ksp | 1.8×10-10 | 5×10-13 |
①CH3X通入AgNO3的乙醇溶液中,除有沉淀生成外,还生成硝酸甲酯,请写出硝酸甲酯的结构简式______________。
②CH3Cl和CH3Br的混合气体通入AgNO3的乙醇溶液中,先出现淡黄色沉淀。请依据表中数据解释原因__________________。
③设计实验证明Ksp(AgCl)>Ksp(AgBr):___________(简要说明实验操作、现象和结论)。
【答案】 CH3OH+HCl![]() CH3Cl+H2O Zn(OH)2(或ZnO) 除去氯化氢气体 (c1V1-c2V2)×10-3 CH3ONO2(写成CH3NO3也可) C—Br键的键能小,更容易断裂,同时溴化银的溶度积更小,溴化银更容易形成沉淀 向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成淡黄色沉淀,则证明Ksp(AgCl)>Ksp(AgBr)(其他合理答案也可)
CH3Cl+H2O Zn(OH)2(或ZnO) 除去氯化氢气体 (c1V1-c2V2)×10-3 CH3ONO2(写成CH3NO3也可) C—Br键的键能小,更容易断裂,同时溴化银的溶度积更小,溴化银更容易形成沉淀 向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成淡黄色沉淀,则证明Ksp(AgCl)>Ksp(AgBr)(其他合理答案也可)
【解析】考查实验方案设计与评价,(1)①装置A为制备CH3Cl,ZnCl2作催化剂,即圆底烧瓶中发生反应的化学方程式为CH3OH+HCl![]() CH3Cl+H2O;根据所加物质,白色物质是Zn(OH)2或ZnO;②盐酸容易挥发,因此装置B的作用是除去挥发出的HCl气体;③ CH3Cl燃烧产生CO2和HCl,CO2与NaOH反应:2NaOH+CO2=Na2CO3+H2O,HCl+NaOH=NaCl+H2O,然后以甲基橙为指示剂,用盐酸滴定吸收液,发生NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,两次消耗的差值,应为一氯甲烷燃烧生成HCl的量,即为(V1c1-V2c2)×10-3mol,根据氯元素守恒,即CH3Cl的物质的量为(V1c1-V2c2)×10-3mol;(2)①根据酯的命名,硝酸甲酯的结构简式为CH3ONO2;②根据表格数据,淡黄色沉淀是AgBr,原因是C-Br键的键能小,更容易断裂,同时溴化银的溶度积更小,溴化银更容易形成沉淀;③向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成淡黄色沉淀,则证明Ksp(AgCl)>Ksp(AgBr);或者向足量氯化钠溶液滴加少量的硝酸银溶液,出现白色沉淀,然后向溶液中滴加溴化钠溶液,出现淡黄色沉淀,说明Ksp(AgCl)>Ksp(AgBr)。
CH3Cl+H2O;根据所加物质,白色物质是Zn(OH)2或ZnO;②盐酸容易挥发,因此装置B的作用是除去挥发出的HCl气体;③ CH3Cl燃烧产生CO2和HCl,CO2与NaOH反应:2NaOH+CO2=Na2CO3+H2O,HCl+NaOH=NaCl+H2O,然后以甲基橙为指示剂,用盐酸滴定吸收液,发生NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O,两次消耗的差值,应为一氯甲烷燃烧生成HCl的量,即为(V1c1-V2c2)×10-3mol,根据氯元素守恒,即CH3Cl的物质的量为(V1c1-V2c2)×10-3mol;(2)①根据酯的命名,硝酸甲酯的结构简式为CH3ONO2;②根据表格数据,淡黄色沉淀是AgBr,原因是C-Br键的键能小,更容易断裂,同时溴化银的溶度积更小,溴化银更容易形成沉淀;③向等浓度的氯化钠和溴化钠的混合溶液中滴加硝酸银溶液,先生成淡黄色沉淀,则证明Ksp(AgCl)>Ksp(AgBr);或者向足量氯化钠溶液滴加少量的硝酸银溶液,出现白色沉淀,然后向溶液中滴加溴化钠溶液,出现淡黄色沉淀,说明Ksp(AgCl)>Ksp(AgBr)。

【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
【题目】已知E1=134kJ/mol、E2=368kJ/mol,请参考题中图表,按要求填空: 
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,NO2和CO反应的热化学方程式为: .
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应. 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3= .
(3)下表所示是部分化学键的键能参数:
化学键 | P﹣P | P﹣O | O═O | P═O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热为d kJ/mol,白磷及其完全燃烧生成的产物的结构如图Ⅱ所示,表中x= kJ/mol(用含a、b、c、d的代数式表示).
【题目】一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.前 5 s 的平均反应速率v(A)=0.03 molL﹣1s﹣1
B.正反应是吸热反应
C.保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
D.保持温度不变,起始时向容器中充入0.2molA,0.2molB和1molC,反应达到平衡前v(正)<v(逆)