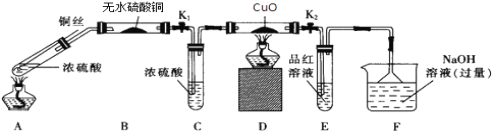
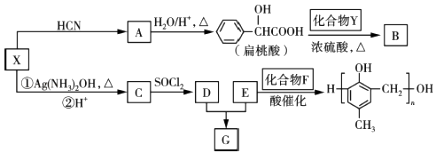
题目内容
【题目】在T℃时,将0.6molX和0.4molY置于容积为2L的密闭容器中(压强为mPa)发生反应:3X(g)+Y(g)![]() 2Z(g)该反应为放热反应。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:
2Z(g)该反应为放热反应。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:
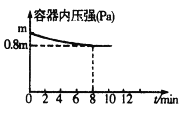
(1)8分钟内Z的平均生成速率为____________。
(2)X的平衡转化率为____________。
(3)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a∶b=____________。
(4)下列措施能加快化学反应速率的是____________。
A.恒压时充入He B.恒容时充入He
C.恒容时充入X D.及时分离出Z
E.升高温度 F.选择高效的催化剂
(5)仍在T℃时,将0.6molX和0.4molY置于一容积可变的密闭容器中。下列各项能说明该反应已达到平衡状态的是______。
a.容器内X、Y、Z的浓度之比为3∶1∶2
b.3v正(X)=v逆(Y)
c.混合气体的密度保持不变
d.容器中气休的平均相对分子质量不随时间而变化
【答案】 0.0125mol·L-1·min-1 50% 5 :3 CEF cd
【解析】(1)根据反应后的压强计算容器内气体的物质的量,根据反应的方程式结合三段式计算;
(2)X的转化率等于消耗的X的物质的量与X的起始物质的量的比值;
(3)根据反应的方程式结合三段式计算;
(4)根据外界条件对反应速率的影响分析;
(5)结合平衡的特征“等、定”及衍生的物理量判定平衡状态。
(1)将0.6molX和0.4molY置于容积2L的密闭容器中,图中平衡时压强变为原来的0.8倍,则平衡时物质的量为(0.6mol+0.4mol)×0.8=0.8mol。
3X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始量(mol) 0.6 0.4 0
转化量(mol) 3n n 2n
平衡量(mol) 0.6-3n 0.4-n 2n
则0.6-3n+0.4-n+2n=0.8,解得n=0.1
则8分钟内Z的平均生成速率为![]() =0.0125mol·L-1·min-1;
=0.0125mol·L-1·min-1;
(2)X的平衡转化率为0.3/0.6×100%=50%;
(3) 3X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始量(mol) a b 0
转化量(mol) 3x x 2x
平衡量(mol) a-3x b-x 2x
则a-3x=b-x=2x
解得a=5x,b=3x,则原混合气体中a∶b=5:3;
(4)A.恒压时充入He,容器体积增大,浓度减小,反应速率减小;B.恒容时充入He,浓度不变,反应速率不变;C.恒容时充入X,浓度增大,反应速率加快;D.及时分离出Z浓度减小,反应速率减小;E.升高温度,反应速率加快;F.选择高效的催化剂,反应速率加快;答案选CEF;
(5)a.容器内X、Y、Z的浓度之比为3∶1∶2与起始浓度、转化率有关,不能判定平衡;b.3v正(X)=v逆(Y)时正逆反应速率不相等,不是平衡状态;c.密度是混合气的质量和容器容积的比值,在反应过程中质量是不变的,但容器容积是变化的,因此混合气体的密度保持不变时反应达到平衡状态;d.气体的物质的量为变量,质量不变,则容器中气体的平均相对分子质量不随时间变化而变化,为平衡状态;答案选cd。

【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。