��Ŀ����
����Ŀ��(1)��֪����Fe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
��2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��__________________��ijͬѧ��Ϊ�����ȷ�Ӧ�����ڹ�ҵ����������ж���_____(������������������)��������________��
(2)��Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ��������µķ�Ӧ���̷ֱ�ΪA��B��ͼ��ʾ��
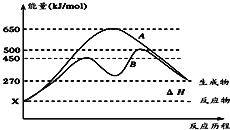
����ͼ�жϸ÷�Ӧ��_______(����������������)�ȷ�Ӧ��
������B���̱����˷�Ӧ���õ�����Ϊ________(����ĸ)��
A.�����¶� B.����Ӧ���Ũ�� C.�����¶� D.ʹ�ô���
(3)���ȷ��dz��õĽ�����������֮һ����֪��
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��___________________��
(4)�й�����ֵ�������ʾ��2013�����ƽ����������Ϊ52����֮��γ���������Ҫ�ɷ�Ϊ�����������ŷŵķ���������β�����ﳾ�ȡ���CH4������������β���е����������Ⱦ��
��֪��CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
д��CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽ________________��
���𰸡� 2Al��s��+3FeO��s����Al2O3��s��+3Fe��s��H=-859.7kJ/mol ���� �÷�Ӧ��Ҫ��������Ҫ���Ĵ����������ɱ��ϸ� �� D 4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol CH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol
����������1�����ݸ�˹���ɼ����H���÷�Ӧ��Ҫ�������ɱ����ߣ�
��2������ͼ��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ��
����ͼ��֪����Ӧ����B��A��ȣ��ı䷴Ӧ���̣�Ӧ��ʹ�ô�����
��3�����ݸ�˹���ɼ����H��
��4�����ݸ�˹���ɼ����H��
��1����֪����Fe(s)+1/2O2(g)=FeO(s) H1=-272.0kJ/mol
��2Al(s)+3/2O2(g)=Al2O3(s) H1=-1675.7kJ/mol
������ʽ��-�١�3��2Al��s��+3FeO��s����Al2O3��s��+3Fe��s����H=-1675.7kJmol-1-��3��-272.0kJmol-1��=-859.7 kJmol-1��
���ȷ�Ӧ��Ҫþȼ�����������Ľ϶��������ɷֹ��ߣ���˲������ڹ�ҵ������
��2������ͼ��֪����Ӧ�����������������������������÷�ӦΪ���ȷ�Ӧ��
����ͼ��֪����Ӧ����B��A��ȣ��ı䷴Ӧ���̣����ﵽ��ͬ��ƽ��״̬���ı������Ӧ��ʹ�ô��������ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���ΪD��
��3����֪����4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
��Mn(s)+O2(g)=MnO2(s) H=-521kJ/mol
���ݸ�˹���ɿ�֪�٣��ڡ�3���õ�Al��MnO2��Ӧұ������Mn���Ȼ�ѧ����ʽ��4A1(s)+3MnO2(s)=3Mn(s)+2Al2O3(s)H=-1789kJ/mol��
��4����֪����CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
��2NO2(g)=N2O4(g) H=-56.9kJ/mol
���ݸ�˹���ɿ�֪�٣��ڼ��õ�CH4����ԭN2O4(g)����N2��H2O(l)���Ȼ�ѧ����ʽCH4(g)+N2O4(g)=N2(g)+2H2O(l)+CO2(g)H=898.1kJ/mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��һ���¶��£���2L���������г���1molA��1molB��������ӦA��g��+B��g��=C��g������һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ�������������¶�˵����ȷ���ǣ�������
t/s | 0 | 5 | 15 | 25 | 35 | |
n��A��/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.ǰ 5 s ��ƽ����Ӧ����v��A��=0.03 molL��1s��1
B.����Ӧ�����ȷ�Ӧ
C.�����¶Ȳ��䣬��ʼʱ�������г���2molC����ƽ��ʱ��C��ת���ʴ���80%
D.�����¶Ȳ��䣬��ʼʱ�������г���0.2molA��0.2molB��1molC����Ӧ�ﵽƽ��ǰv��������v���棩