题目内容
【题目】25℃时,往HA溶液中滴加NaOH溶液,溶液中HA和A-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
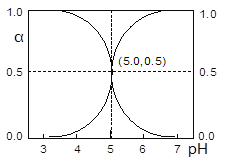
A. 在pH=5.0的溶液中,c(A-)=c(HA),c(OH-)= c(H+)
B. pH=7的溶液中,α(HA)=0,α(A-)=1.0
C. 25℃时,Ka(HA)=1×10-5
D. pH=5.0时,溶液中水电离产生的c(H+)=1×10-5mol·L-1
【答案】C
【解析】A、根据图像,pH=5时,c(A-)=c(HA),pH=5时,c(H+)=10-5mol·L-1,c(OH-)=10-9mol·L-1,故A错误;B、根据图像,pH=7时,c(HA)接近于0,但不等于0,故B错误;C、电离平衡常数只受温度的影响,因此pH=5时,Ka=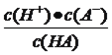 =10-5mol·L-1,故C正确;D、pH=5时,溶液中c(H+)=10-5mol·L-1,依据水的离子积,c(OH-)=10-9mol·L-1,水电离出的c(H+)等于水电离出的c(OH-),即水电离产生的c(H+)=10-9mol·L-1,故D错误。
=10-5mol·L-1,故C正确;D、pH=5时,溶液中c(H+)=10-5mol·L-1,依据水的离子积,c(OH-)=10-9mol·L-1,水电离出的c(H+)等于水电离出的c(OH-),即水电离产生的c(H+)=10-9mol·L-1,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。
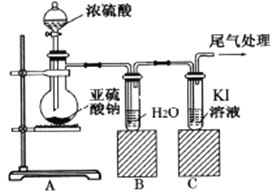
步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二 :打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C 试管中溶液的pH。
结合上述实验,回答以下问题:
(1) 甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质。该物质发生电离,其电离方程式为___________。
(2) 乙同学认为C瓶中pH可能更小,因为C中二氧化硫会像氧化硫化氢一样与碘离子发生氧化还原反应。通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是____________。测定结果如下:
第1次实验 | 第2次实验 | 第3 次实验 | |
B 瓶中pH | 2.15 | 2.10 | 2. 17 |
C 瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现: C瓶中溶液的酸性始终比B瓶中的酸性强。
(3) 通过仔细观察,C瓶中溶液从无色变成浅黄色同时出现黄色浑浊,继续通入气体溶液又逐渐变为无色。其中溶液变黄且出现浑浊的过程对应的离子方程式为________,为了检验产物,中间取出少许溶液加入______,溶液变蓝,证明乙同学判断正确;黄色溶液又逐渐变为无色对应的化学反应方程式为_______________。
(4) 最终结论:
①B瓶中溶液呈弱酸性是由于__________。
②C瓶中溶液呈强酸性是由于生成了_________,该过程中体现出二氧化硫哪些化学性质_____。
【题目】利用硫铁矿烧渣(主要成分为Fe2O3,还含有少量Al2O3、 MgO、SiO2等杂质)制备铁红工艺流程如下:

回答下列问题:
(1)还原焙烧后,Fe元素的化合价为__________。
(2)“酸浸”实验中,需加入絮凝剂沉淀杂质。絮凝剂用量和过滤时间对铁红成份的影响如下表所示。由表可知,所采用的最佳实验条件为__________(填序号)。
序号 | 絮凝剂用量/×10-6t | 过滤时间/min | Fe2O3含量% | SiO2含量% |
① | 40 | 5 | 96.5 | 0.12 |
② | 50 | 10 | 97.9 | 0.10 |
③ | 60 | 20 | 98.3 | 0.07 |
④ | 100 | 40 | 99.4 | 0.01 |
⑤ | 150 | 150 | 99.5 | 0.008 |
(3)若“合成”中c(Mg2+)=0.01mol/L,加入NH4HCO3(设溶液体积增加1倍),当Fe2+恰好沉淀完全时,溶液中c(Fe2+)=1.0×10-5mol/L,此时是否有MgCO3沉淀生成?__________(列式计算)。FeCO3、MgCO3的Ksp分别为3.2×10-11、3.0×10-8。
(4)“合成”过程中发生反应的离子方程式为_____________。
(5)“合成”过程中温度对亚铁离子转化率的影响如下图,分析选择反应温度为40℃的原因是________。

(6)“煅烧”中由FeCO3制备Fe2O3的化学方程式为________。
(7)本流程中,铝元素是以________(填化学式)形式被除去的。
