题目内容
12.下列说法正确的是( )| A. | 标准状况下44.8L乙醇含有氢原子数为12NA | |
| B. | 1mol气体的体积只有在标准状况下才是22.4L | |
| C. | 常温常压下,等质量的N2和N4中所含氮原子数相同 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约3.01×1022个原子 |
分析 A、标况下,乙醇不是气体,是液体;
B、依据PV=nRT分析;
C、根据公式N=nNA=$\frac{m}{M}$NA来计算;
D、都是双原子分子,混合物原子数和化合气体物质的量有关.
解答 解:A、标准状况乙醇不是气体,44.8L乙醇不是2mol,含有氢原子数不是12NA,故A错误;
B、PV=nRT分析可知标准状况气体摩尔体积是22.4L/mol,温度压强等倍数变化,气体体积可以是22.4L,故B错误;
C、等质量的N4与N2含氮原子的个数之比是$\frac{m}{56}×4:\frac{m}{28}×2$=1:1,故C正确;
D、标准状况下1.12L CO和N2的混合气体物质的量是0.05mol,含有约6.02×1022个原子,故D错误.
故选C.
点评 本题考查了气体摩尔体积的概念分析应用,注意条件分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
2.对废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得ZnSO4•7H2O,其流程如图.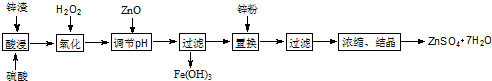
(1)酸浸时温度和时间对锌浸出率的影响如表.
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃
(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
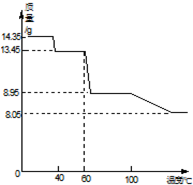
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)

(1)酸浸时温度和时间对锌浸出率的影响如表.
| 酸浸时间/h | 酸浸温度/℃ | 锌浸出率/% |
| 2 | 80 | 87 |
| 2 | 90 | 95 |
| 2 | 110 | 85.3 |
| 3 | 95 | 94.5 |
| 2.5 | 95 | 94 |
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)
3. 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:
(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
①反应在t1 min内的平均速率为v(H2)=$\frac{0.2}{{t}_{1}}$mol/(L.min);判定t1达平衡状态的理由是t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化.
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
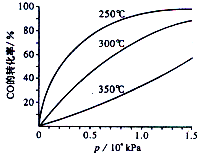
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
20.将500mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol NaOH的烧碱溶液,恰好完全反应;另取一份加入含b mol HCl的盐酸,恰好完全反应.则该混合溶液中c(Na+)(单位:mol•L-1)为( )
| A. | $\frac{2b-a}{20}$ | B. | 2b-a | C. | 5b-$\frac{5a}{2}$ | D. | 10b-5a |
7.已知氯元素某种原子的质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 由题中信息可知 NA的值为$\frac{12}{b}$ | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | W g该原子中含有的电子数为$\frac{17W}{a{N}_{A}}$ | |
| D. | 该原子的摩尔质量是aNAg/mol |
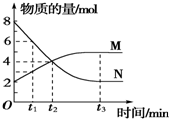 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题:
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.请回答下列问题: