题目内容
7.已知氯元素某种原子的质量是a g,12C原子的质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是( )| A. | 由题中信息可知 NA的值为$\frac{12}{b}$ | |
| B. | Wg该原子的物质的量一定是$\frac{W}{a{N}_{A}}$mol | |
| C. | W g该原子中含有的电子数为$\frac{17W}{a{N}_{A}}$ | |
| D. | 该原子的摩尔质量是aNAg/mol |
分析 A.12g12C含有的原子数为阿伏伽德罗常数个;
B.已知质量求物质的量,运用公式n=$\frac{m}{M}$计算;
C.Wg含有$\frac{W}{a}$ 个原子,Cl原子含有17个电子;
D.摩尔质量是单位物质的量的物质的质量,单位为g/mol.
解答 解:A、1mol任何粒子的粒子数叫做阿伏伽德罗常数,以12g12C中所含碳原子数定义为阿伏伽德罗常数,应为NA=$\frac{12}{b}$,故A正确;
B、物质的量=$\frac{m}{M}$=$\frac{W}{aNA}$ mol,或物质的量=$\frac{W}{\frac{a}{b}×\frac{1}{12}}$=$\frac{bW}{12a}$mol,故B正确;
C、一个原子的质量是a g,Wg 该原子中原子个数=$\frac{Wg}{ag}$=$\frac{W}{a}$ 个,则电子数为$\frac{17W}{a}$,故C错误;
D、摩尔质量:单位物质的量的物质所具有的质量,单位是g•mol-1,一个原子的质量是a g,则1mol的质量即NA个原子的质量为aNAg,所以摩尔质量应为aNAg•mol-1,故D正确;
故选C.
点评 本题考查了相对原子质量、物质的量、摩尔质量等概念,该题概念辨析要求高,为高频考点,平时学习时需理解这些概念与相关概念的区别和联系,题目难度中等.

练习册系列答案
相关题目
18.在一固定容积的密闭容器中加入2molX和3molY气体,发生如下反应:nX(g)+3Y(g)?2R(g)+Q(g)反应达到平衡时,测得X和Y的转化率分别为30%和60%,则化学方程式中的n值为 ( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
15. 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是c;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.减少副产物乙醚生成 d.防止乙醇挥发
(2)在装置C中应加入b,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)判断该制备实验实各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用a洗涤除去;(填正确选项前的字母)
a.氢氧化钠溶液 b.碘化钠溶液 c.水 d.Na2SO3溶液
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是c;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.减少副产物乙醚生成 d.防止乙醇挥发
(2)在装置C中应加入b,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)判断该制备实验实各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用a洗涤除去;(填正确选项前的字母)
a.氢氧化钠溶液 b.碘化钠溶液 c.水 d.Na2SO3溶液
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
2.下列物质混合后,不会发生离子反应的是( )
| A. | NaOH溶液和FeCl3溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | CuSO4溶液和Ba(OH)2溶液 | D. | Na2SO4溶液和MgCl2溶液 |
12.下列说法正确的是( )
| A. | 标准状况下44.8L乙醇含有氢原子数为12NA | |
| B. | 1mol气体的体积只有在标准状况下才是22.4L | |
| C. | 常温常压下,等质量的N2和N4中所含氮原子数相同 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约3.01×1022个原子 |
16.下列描述中正确的是( )
①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化.
①CS2为V形的极性分子
②ClO3-的空间构型为平面三角形
③SF6中有6对完全相同的成键电子对
④SiF4和SO32-的中心原子均为sp3杂化.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
17.在3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中,既是氧化剂又是还原剂的是( )
| A. | Cl2 | B. | NaOH | C. | H2O | D. | NaClO3 |
 ,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目:
,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目: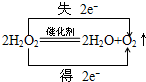 .
.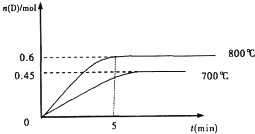 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题: