题目内容
2.(1)提取溴水中的溴,可采用的方法:萃取.(2)用作发酵粉,或者用于治疗胃酸过多的物质是:小苏打(NaHCO3).
(3)写出实验室制氯气的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
分析 (1)溴易溶于有机溶剂;
(2)碳酸氢钠常用作发酵粉;
(3)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气.
解答 解:(1)溴易溶于有机溶剂,可用萃取的方法分离,故答案为:萃取;
(2)碳酸氢钠常用作发酵粉,也可用于治疗胃酸过多,故答案为:小苏打(NaHCO3);
(3)实验室用浓盐酸与二氧化锰在加热条件下发生反应制备氯气,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
点评 本题考查较为综合,涉及物质的分离提纯、钠盐以及氯气的制备,侧重于学生综合运用化学知识的能力和实验能力的考查,为高考常见题型,题目难度不大,注意把握物质的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列说法正确的是( )
| A. | 标准状况下44.8L乙醇含有氢原子数为12NA | |
| B. | 1mol气体的体积只有在标准状况下才是22.4L | |
| C. | 常温常压下,等质量的N2和N4中所含氮原子数相同 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约3.01×1022个原子 |
13.按要求完成下列各题
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
10.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增加的方法是( )
| A. | 增大反应物浓度 | B. | 升高温度 | C. | 增大压强 | D. | 加入正催化剂 |
17.在3Cl2+6NaOH=5NaCl+NaClO3+3H2O反应中,既是氧化剂又是还原剂的是( )
| A. | Cl2 | B. | NaOH | C. | H2O | D. | NaClO3 |
14.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0;一定温度下,向10L恒容密闭容器中通入N2O5,的部分实验数据见下表:下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol | 5.00 | 3.5 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为3×10-4mol•(L•s)-1 | |
| B. | 反应达平衡后,往容器中加入5molN2O5气体,平衡正向移动,反应的热效应变大 | |
| C. | 相同温度下,起始时向容器中充入5molNO2和1.25molO2,达到平衡时,NO2的转化率小于50% | |
| D. | 达到平衡后,相同条件下往容器中充入2.5molN2O5和1.25molO2,此时平衡将向右移动 |
11.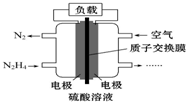 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
 液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,H2SO4作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 负极发生的电极反应式为N2H4-4e-═N2↑+4H+ | |
| C. | 利用该燃料电池工业上可以电解MgCl2溶液制备Mg | |
| D. | 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故c(H+)逐渐减小 |
12.下列条件下,两瓶气体所含原子数一定相等的是( )
| A. | 同质量、不同密度的N2和CO2 | B. | 同温度、同体积的H2和N2 | ||
| C. | 同体积、同密度的O2和O3 | D. | 同压强、同体积的NO2和CO2 |