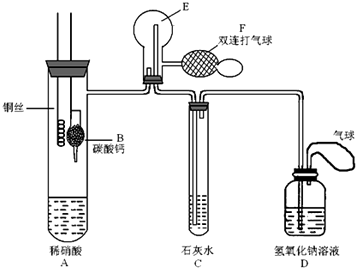
题目内容
2.对废锌渣(主要成分是ZnO、FeO、Fe2O3、CuO)进行适当处理可制得ZnSO4•7H2O,其流程如图.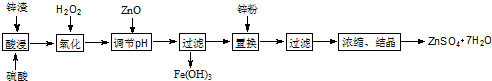
(1)酸浸时温度和时间对锌浸出率的影响如表.
| 酸浸时间/h | 酸浸温度/℃ | 锌浸出率/% |
| 2 | 80 | 87 |
| 2 | 90 | 95 |
| 2 | 110 | 85.3 |
| 3 | 95 | 94.5 |
| 2.5 | 95 | 94 |
 综合考虑,反应的最佳温度和时间是2h、90℃
综合考虑,反应的最佳温度和时间是2h、90℃(2)氧化时也可改通空气,其原因是4Fe2++O2+4H+═4Fe3++2H2O.(用离子方程式表示)
(3)加入锌粉的目的是除去Cu2+.
(4)检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽.
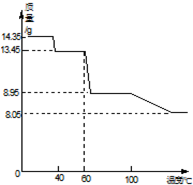
(5)取14.35gZnSO4•7H2O加热分解,加热过程中,固体质量随温度的变化如图所示.写出从60℃到80℃时发生的反应ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.(用化学方程式表示)
分析 氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,加双氧水将与亚铁离子氧化成铁离子,加入氧化锌,调节溶液的pH值,使铁离子生成氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体,
(1)根据表中数据,结合锌浸出率最高的一组数据判断;
(2)空气的氧气可以氧化亚铁离子,根据电荷守恒和元素守恒可写出离子方程式;
(3)根据上面的分析可知,锌粉可以置换出铜,而除去溶液中的铜离子;
(4)铁离子遇KSCN溶液呈血红色,据此可以检验Fe3+;
(5)28.70 g ZnSO4•7H2O的物质的量为0.05mol,由Zn元素守恒可知,生成ZnSO4•H2O或ZnSO4或ZnO或Zn3O(SO4)2时,物质的量均为0.05mol,根据它们的质量确定产物的化学式,根据元素守恒可写出化学方程式.
解答 解:氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,加双氧水将与亚铁离子氧化成铁离子,加入氧化锌,调节溶液的pH值,使铁离子生成氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体,
(1)根据表中数据可知,当时间为2h、温度为90℃时锌浸出率最高为95%,所以反应的最佳温度和时间是,
故答案为:2h、90℃;
(2)空气的氧气可以氧化亚铁离子,反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(3)根据上面的分析可知,锌粉可以置换出铜,而除去溶液中的铜离子,
故答案为:除去Cu2+;
(4)铁离子遇KSCN溶液呈血红色,所以检验Fe3+是否除尽的方法是取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽,
故答案为:取第一次过滤后的滤液少许于试管中,加KSCN溶液,若溶液无血红色出现,则Fe3+已除尽;
(5)28.70 g ZnSO4•7H2O的物质的量为0.05mol,由Zn元素守恒可知,生成ZnSO4•H2O或ZnSO4或ZnO时,物质的量均为0.05mol,它们的质量依次为8.95、8.05、4.15,所以此时产物的化学式应为ZnSO4•H2O,所以反应的化学方程式为ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O,
故答案为:ZnSO4•6H2O$\frac{\underline{\;△\;}}{\;}$ZnSO4•H2O+5H2O.
点评 本题以ZnSO4•7H2O的制备为知识背景,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、化学方程式的书写、计算等知识,题目难度中等,侧重于考查学生的分析能力和实验能力.

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案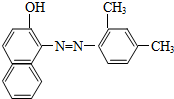
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到,发生了化学反应 | |
| B. | 干馏煤可以得到苯和氨等重要化工原料 | |
| C. | 如图所示物质属于芳香烃 | |
| D. | 如图所示物质能被酸性高锰酸钾氧化 |

(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红或溴水或KMnO4溶液.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:
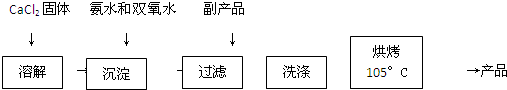
反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
| 实验序号 | ① | ② | ③ | ④ |
| 消耗 KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.
| A. | 标准状况下44.8L乙醇含有氢原子数为12NA | |
| B. | 1mol气体的体积只有在标准状况下才是22.4L | |
| C. | 常温常压下,等质量的N2和N4中所含氮原子数相同 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约3.01×1022个原子 |
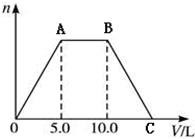 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答: ,用单线桥法分析上述反应.
,用单线桥法分析上述反应. ,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目:
,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目: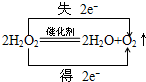 .
.