题目内容
3. 科研生产中常涉及碳的化合物.请回答下列问题:
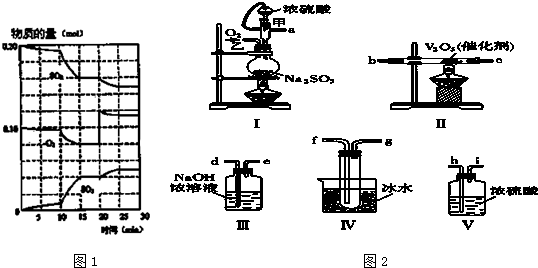
科研生产中常涉及碳的化合物.请回答下列问题:(1)700℃时,向容积为3L的密闭容器中充人一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
| 反应时间/min | N[CO(g)]mol | N[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | y | 0.3 |
②保持其他条件不变,起始时向容器中充入0.9mol CO和1.8mol H2O(g),达平衡时,CO2的物质的量浓度c(CO2)=0.2mol/L.
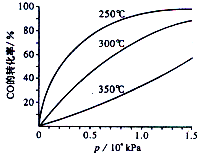
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下平衡转化率与压强的关系如图所示.该反应的△H<0(填“>”、“=”或“<”),实际生产条件控制在250℃,1.3×l04kPa左右,选择此压强的理由是在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本.
(3)CH4和H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,通过计算求CH4的平衡转化率(保留2位小数).
分析 (1)①根据v=$\frac{△c}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(H2);
t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,说明t1 min时到达平衡;
②CO、H2O按1:1反应,与原平衡相比二者物质的量互换,由于平衡常数不变,则平衡时二氧化碳的浓度相等;
(2)由图可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应;
在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本;
(3)将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,则:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L):x x 0 0
转化量(mol/L):0.1 0.1 0.1 0.3
平衡量(mol/L):x-0.1 x-0.1 0.1 0.3
再根据平衡常数列方程计算解答.
解答 解:(1)①v(CO)=$\frac{\frac{1.8mol-1.2mol}{3L}}{{t}_{1}min}$=$\frac{0.2}{{t}_{1}}$mol/(L.min),速率之比等于化学计量数之比,则v(H2)=(CO)=$\frac{0.2}{{t}_{1}}$mol/(L.min);
t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化,说明t1 min时到达平衡,
故答案为:$\frac{0.2}{{t}_{1}}$mol/(L.min);t1 min时生成水的物质的量为0.3mol,与t2 min时生成水的物质的量相等,不再随时间发生变化;
②CO、H2O按1:1反应,与原平衡相比二者物质的量互换,由于平衡常数不变,则平衡时二氧化碳的浓度相等,则达平衡时,CO2的物质的量浓度c(CO2)=$\frac{1.8mol-1.2mol}{3L}$=0.2mol/L,
故答案为:0.2mol/L;
(2)由图可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应故△H<0;
在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本,故选择1.3×l04kPa左右,
故答案为:<;在1.3×l04kPa左右,CO的转化率已经较高,再增大压强,对设备要求较高,增大成本;
(3)将等物质的量的CH4和H2O(g)充入2L恒容密闭反应器,某温度下反应达平衡,平衡常数值K=27,此时测得n(CO)=0.2mol,则:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L):x x 0 0
转化量(mol/L):0.1 0.1 0.1 0.3
平衡量(mol/L):x-0.1 x-0.1 0.1 0.3
故$\frac{0.1×0.{3}^{3}}{(x-0.1)×(x-0.1)}$=27,解得x=0.11,
则CH4的平衡转化率为$\frac{0.1mol/L}{0.11mol/L}$×100%≈90.91%,
答:CH4的平衡转化率为90.91%.
点评 本题考查化学平衡计算与影响因素、反应速率计算,注意三段式解题法在化学平衡计算中应用,注意理解掌握平衡常数应用,难度中等.


(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红或溴水或KMnO4溶液.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:
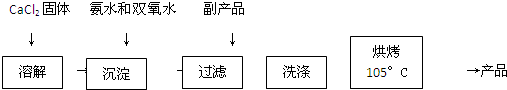
反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
| 实验序号 | ① | ② | ③ | ④ |
| 消耗 KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是c;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.减少副产物乙醚生成 d.防止乙醇挥发
(2)在装置C中应加入b,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.浓硫酸 d.饱和碳酸氢钠溶液
(3)判断该制备实验实各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用a洗涤除去;(填正确选项前的字母)
a.氢氧化钠溶液 b.碘化钠溶液 c.水 d.Na2SO3溶液
(6)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. | 标准状况下44.8L乙醇含有氢原子数为12NA | |
| B. | 1mol气体的体积只有在标准状况下才是22.4L | |
| C. | 常温常压下,等质量的N2和N4中所含氮原子数相同 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约3.01×1022个原子 |
(1)精炼铜时,阴极材料是纯铜,阴极的电极反应式是Cu2++2e-=Cu,
(2)氯碱工业电解饱和食盐水的总反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(3)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-=MnO2+4H+
(4)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-离子.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的液.
| 离子 | Cu2+ | H+ | Cl- | SO$\stackrel{2-}{4}$ |
| c/(mol•L-1) | 1 | 4 | 4 | 1 |
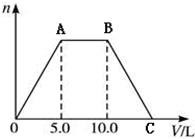 向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答:
向NaOH和Ca(OH)2的混合溶液中不断地通入足量的CO2气体,生成的沉淀的物质的量(n)和通入CO2气体体积(V)的关系如图,试回答: