题目内容
8.某同学测得物质的量浓度均为0.01mol•L-1的醋酸和醋酸钠的混合溶液呈酸性后,得出下列关系式,你认为不正确的是( )| A. | c(CH3COO -)>c(CH3COOH) | B. | c(CH3COO -)>c(Na+)>c(H+)>c(OH -) | ||
| C. | c(Na+)=c(CH3COO -)=0.01mol•L-1 | D. | c(CH3COOH)+c(CH3COO -)=0.02mol•L-1 |
分析 物质的量浓度均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,则醋酸的电离大于醋酸钠中醋酸根离子的水解,以此来解答.
解答 解:A.醋酸的电离大于醋酸钠中醋酸根离子的水解,即c(CH3COO-)略大于0.01mol/L,c(CH3COOH)略小于0.01mol/L,所以c(CH3COO-)>c(CH3COOH),故A正确;
B.均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液呈酸性后,醋酸的电离大于醋酸钠中醋酸根离子的水解,溶液显酸性,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.c(Na+)=0.01mol/L,而c(CH3COO-)略大于0.01mol/L,故C错误;
D.根据物料守恒可知,均为0.01mol•L -1的CH3COOH和CH3COONa的混合溶液中c(CH3COOH)+c(CH3COO-)=0.02mol•L-1,故D正确;
故选C.
点评 本题考查溶液中离子浓度大小的比较,明确溶液中酸的电离大于盐类的水解是解答本题的关键,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
16.足量的氯气和盐酸分别与等质量的铁反应,铁原子失去的电子数目前者与后者的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
3.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
20.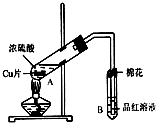 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
根据上表数据计算判断x的实侧值比理论值(x=5)偏小(填“偏大”、“偏小”),这次实验中产生误差的原因可能是AD(填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
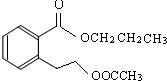
18.有机物结构如图所示,下列说法中不正确的是( )


| A. | 与稀H2SO4共热,生成2种有机物 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
 .
. 任意2个.
任意2个.