题目内容
14.常温下,下列各组离子一定能大量共存的是( )| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
分析 A.pH=1的溶液中含有大量氢离子,硫氢根离子与氢离子反应;
B.水电离出的c(H+)=10-12mol/L溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应,钡离子与碳酸根离子反应生成碳酸钡沉淀;
C.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.碳酸氢根离子与铝离子之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.pH=1的溶液中含有大量氢离子,HS-与氢离子反应生成硫化氢,在溶液中不能大量共存,故A错误;
B.水电离出的c(H+)=10-12mol/L溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,CO32-与氢离子反应,Ba2+、CO32-离子反应生成碳酸钡沉淀,在溶液中不能大量共存,故B错误;
C.该溶液中存在大量氢氧根离子,CH3COO-、CO32-、Na+、K+离子之间不反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
2.下列关于元素周期律和元素周期表的说法中正确的是( )
| A. | 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 | |
| B. | 元素的性质随着原子序数的增加而呈周期性变化 | |
| C. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 | |
| D. | 目前已知发现的第ⅥA族元素为5种,所以该族元素共有5种单质 |
19.常温下,向10mL0.1mol•L-1的HCl溶液中逐滴加入0.1mol•L-1的NH3•H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得.下列有关说法中一定错误的是( )
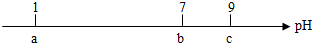
| A. | 常温下,0.1mol•L-1的HCl溶液的pH=1 | |
| B. | 当pH=7时,所加NH3•H2O溶液的体积大于10mL | |
| C. | 当7<pH<9时,溶液中c(NH4+)>c(Cl-) | |
| D. | 继续滴加0.1mol•L-1的NH3•H2O溶液,溶液的pH最终可以变化至13 |
6.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 原子半径大小:Na>Mg>Al | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 金属性强弱:Na>Mg>Al |
3.下列说法错误的是( )
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| C. | 煤经过气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5分散在空气中可能形成胶体或浊液 |
4.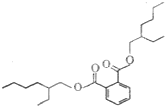 塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )
塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )
 塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )
塑化剂是工业上被广泛使用的高分子材料添加剂,食用后对人体有害,其结构式如图.下列有关塑化剂的说法正确的是( )| A. | 易溶于水,其水溶液有丁达尔效应 | B. | 在稀硫酸中不能稳定存在 | ||
| C. | 不能发生还原反应 | D. | 不能发生氧化反应 |
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应: