题目内容
9.已知A、B、C均为短周期元素,A、B两种元素的原子具有相同数目的电子层,A元素原子最外层电子数是B元素原子最外层电子数的两倍,A元素原子M层电子数为K层电子数的3倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍.请完成下列空白:(1)A元素为S,C元素为Mg,B元素的名称为铝.
(2)A位于元素周期表中第三周期第ⅥA 族
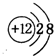
(3)C的离子结构示意图为
(4)A、B、C三种元素形成的原子半径由大到小的顺序是Mg>Al>S(化学符号)
(5)A、B、C三种元素最高价氧化物对应的水化物中分别为H2SO4、Al(OH)3、Mg(OH)2.
分析 A、B、C均为短周期元素,A元素原子M层电子数为K层电子数的3倍,则M层电子数为6,故A为S元素;A、B两种元素的原子具有相同数目的电子层,二者同周期,A元素原子最外层电子数是B元素原子最外层电子数的两倍,B原子最外层电子数为3,故B为Al;C元素原子的核电荷数是电子层数的4倍,符合条件的原子有O、Mg,其质子数为最外层电子数的6倍,故C为Mg,据此解答.
解答 解:A、B、C均为短周期元素,A元素原子M层电子数为K层电子数的3倍,则M层电子数为6,故A为S元素;A、B两种元素的原子具有相同数目的电子层,二者同周期,A元素原子最外层电子数是B元素原子最外层电子数的两倍,B原子最外层电子数为3,故B为Al;C元素原子的核电荷数是电子层数的4倍,符合条件的原子有O、Mg,其质子数为最外层电子数的6倍,故C为Mg.
(1)由上述分析可知,A为S元素,C为Mg元素,B元素的名称为铝,故答案为:S;Mg;铝;
(2)A为S元素,位于元素周期表中第三周期第ⅥA族,故答案为:三;ⅥA;
(3)C的离子为Mg2+,结构示意图为 ,故答案为:
,故答案为: ;
;
(4)同周期自左而右原子半径减小,故原子半径Mg>Al>S,故答案为:Mg>Al>S;
(5)A、B、C三种元素最高价氧化物对应的水化物分别为H2SO4、Al(OH)3、Mg(OH)2,故答案为:H2SO4;Al(OH)3;Mg(OH)2.
点评 本题考查结构性质位置关系应用,比较基础,关键是根据核外电子排布推断元素,有利于基础知识的巩固.

练习册系列答案
相关题目
4.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素描述正确的是( )
| A. | 在自然界中以化合态的形式存在 | B. | 单质常用作半导体材料和光导纤维 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
14.常温下,下列各组离子一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Cl-、K+、HS- | |
| B. | 水电离出的c(H+)=10-12mol/L中:Ba2+、K+、Cl-、CO32- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的水溶液中:CH3COO-、CO32-、Na+、K+ | |
| D. | c(Al3+)=1mol/L的溶液中:Na+、NO3-、SO42-、HCO3- |
1.下列分子中,VSEPR模型名称和分子立体构型名称相同,且分子中各原子最外层都满足8电子稳定结构的是( )
| A. | CH4 | B. | PCl3 | C. | SiCl4 | D. | XeF4 |
18.下列各项中表达正确的是( )
| A. | F-的结构示意图: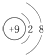 | B. | CH4分子的比例模型: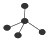 | ||
| C. | CCl4的电子式: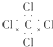 | D. | 乙烯的结构简式:CH2CH2 |
19.下列各物质属于芳香烃的是( )
| A. | 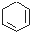 | B. |  | C. | 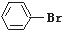 | D. | 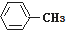 |
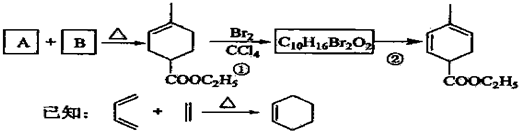
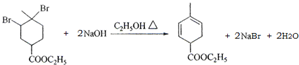 .
.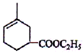 .
.