��Ŀ����
3��2006����������ӵ���ܲ�������25��ֻ��﮵���������Բ��������Ľ�����Դ���������൱��ģ��������ӵ���վ�����Ҫ���壬������Ҫ�ص���յ����������ϣ�����Ҫ�ɷ�Ϊ����ﮣ�LiCoO2����������Ȳ�ڣ�һ��̿�ڣ��������Լ��л�ճ�Ӽ���ij���չ����������£�
��1���������ջ��յ��IJ�����Al��OH��3��CoSO4��Li2CO3��
��2���Ͼɵ�ؿ������ڷŵ粻��ȫ��������ԭ��̬��ﮣ�Ϊ�˰�ȫ�Բ�����Ҫ���Ǹ���������ˮ�֣�
��3�����ʱ��Ҫ��Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2����
��4�����ʱ��Ӧ�Ļ�ѧ����ʽΪ2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2��+4H2O��������������H2SO4��H2O2�Ļ��ҺҲ�ܴﵽ�ܽ��Ŀ�ģ�������֮�������������ɣ���Ⱦ�ϴ�
��5������Li2CO3�Ļ�ѧ��Ӧ����ʽΪLi2SO4+Na2CO3=Na2SO4+Li2CO3������֪Li2CO3��ˮ�е��ܽ�������¶����߶���С�����һ������ʱӦ����
��6��CO��������һ�������¿��Ժϳ����ʻ�����[Fe��CO��5]�������ʿ�������Ǧ���͵ķ���������һ��dz��ɫҺ�壬�����ڱ����л��ܼ���������ˮ������ʱ����Fe2��CO��9��60�淢����ȼ�� ��һ������Fe��CO��5�ı���Һ��������������Ƭ�̣�ȡ��������Һ��ȫȼ�գ��õ�30.58gCO2��5.4gH2O��1.6g����ɫ��ĩ������ɫ��ĩ�Ļ�ѧʽΪFe2O3����������Һ��Fe��CO��5��Fe2 ��CO��9�����ʵ���֮��Ϊ2��1��
���� ����Ĥ�����к���LiCo02�����������������ü�Һ���ݣ���Al����ܽ⣬���˺�õ�����ҺΪ����ƫ�����ƣ�����ΪLiCo02��ͨ��������Һ��pH����ƫ������ת��������������������������˫��ˮ�����ᴦ��������Li2SO4��CoSO4����Ӧ�����ӷ���ʽΪ��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2��+4H2O��ͨ�������ֱ�����Li2SO4��CoSO4��ͨ��Ũ�������뱥��̼������Һ����ˣ����õ�̼��﮹��壬
��1�����ݹ������̵����ղ�����жϻ��յ��IJ��ӦΪAl��OH��3��CoSO4��Li2CO3��
��2���ӽ���﮵Ļ�ѧ���ʷ������Ϊ���ý�����
��3������������ķ�Ӧ���Լ��������������غ㶨�ɺ͵���غ㶨������д���ӷ���ʽ��
��4������������ķ�Ӧ���Լ��������������غ㶨������д��ѧ����ʽ����������Ϣ֪LiCoO2����ǿ�����ԣ�������������Ⱦ�������������ɣ�
��5�����������غ㶨������д��ѧ����ʽ��Li2CO3��ˮ�е��ܽ�������¶ȵ����߶���С��Ӧ���ȹ��ˣ�
��6�����ݺ����Ļ��������ɫ�жϲ��������ԭ�Ӻ�̼ԭ�Ӹ����غ������Fe��CO��5��Fe2��CO��9�����ʵ���֮�ȣ�
��� �⣺����Ĥ�����к���LiCo02�����������������ü�Һ���ݣ���Al����ܽ⣬���˺�õ�����ҺΪ����ƫ�����ƣ�����ΪLiCo02��ͨ��������Һ��pH����ƫ������ת��������������������������˫��ˮ�����ᴦ��������Li2SO4��CoSO4����Ӧ�����ӷ���ʽΪ��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2��+4H2O��ͨ�������ֱ�����Li2SO4��CoSO4��ͨ��Ũ�������뱥��̼������Һ����ˣ����õ�̼��﮹��壬
��1���������̵����ղ���Ϊ��Al��OH��3��CoSO4��Li2CO3��
�ʴ�Ϊ��Al��OH��3��CoSO4��Li2CO3��
��2����������ʻ��ã�����������ˮ������Ӧ��Ӧ����������ˮ�֣�
�ʴ�Ϊ������������ˮ�֣�
��3��������Ӧ����AlO2-����Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����
��4�����ʱ��Ӧ�������ᡢ���������Լ�LiCoO2����������Li2SO4��CoSO4����Ӧ����ʽΪ��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2��+4H2O����������Ϣ֪LiCoO2����ǿ�����ԣ�������������Ⱦ�������������ɣ�
�ʴ�Ϊ��2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2��+4H2O�����������ɣ���Ⱦ�ϴ�
��5����̼������ܣ�����Li2CO3�Ļ�ѧ��Ӧ���ڸ��ֽⷴӦ������ʽΪLi2SO4+Na2CO3=Na2SO4+Li2CO3����Li2CO3��ˮ�е��ܽ�������¶ȵ����߶���С��Ӧ���ȹ��ˣ�
�ʴ�Ϊ��Li2SO4+Na2CO3=Na2SO4+Li2CO3�������ȣ�
��6�����Ļ�������ֻ��Fe2O3Ϊ����ɫ�����Ըù���ΪFe2O3��5.4g H2OΪ��ȼ�����ɣ���
C6H6��6CO2��3H2O
6 3
n��CO2�� $\frac{5.4g}{18g/mol}$
�� n��CO2��=0.6mol
��Fe��CO��5�����ʵ���Ϊxmol��Fe2��CO��9�����ʵ���Ϊymol��
��������ԭ�Ӹ����غ��֪��x+2y=$\frac{1.6g}{160g/mol}$��2=0.02mol��
����̼ԭ�Ӹ����غ��֪��5x+9y=$\frac{30.58g}{44g/mol}$-0.6mol=0.095mol��
��ã�x=0.01mol y=0.005mol x��y=2��1��
�ʴ�Ϊ��Fe2O3��2��1��
���� ����Ϊ���������⣬�漰�����Ļ��ա�����������������ԭ��Ӧ�����ʵķ����ᴿ�ͳ��ӵ����⣬������ʵ�����ƣ�����ʽ����д����ѧƽ�����ʽ����д�����ʵ����ļ�����Ŀ��Ϊ�ۺϣ�����ʱע����ϸ���⣬����Ŀ�л�ȡ�ؼ���Ϣ�������Ѷ��еȣ�

��CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g������H=-574kJ•mol-1
��CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g������H=-1160kJ•mol-1
����˵������ȷ���ǣ�������
| A�� | �ɷ�Ӧ �ٿ���֪��CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O ��l����H��-574 kJ•mol-1 | |
| B�� | ��Ӧ �٢�ת�Ƶĵ�������ͬ | |
| C�� | ���ñ�״����4.48LCH4��ԭNO2��N2���ų�������Ϊ173.4kJ | |
| D�� | ���ñ�״����4.48LCH4��ԭ NO2�� N2������������ת�Ƶĵ�������Ϊ1.60 mol |
| A�� | ��ⱥ��ʳ��ˮ�Ƶý���Na | B�� | �������MgCl2�Ƶý���Mg | ||
| C�� | ������CO��ԭ��������������� | D�� | �����½�̿��ԭ���������Ƶôֹ� |
| A�� | ��״����56g��ԭ�� | B�� | 20�桢101kPaʱ36.5gHCl | ||
| C�� | ��״����6.02��1023��NH3 | D�� | ��״����1molC2H5OH |
 ʵ����ͨ����Ũ������Ҵ���Ӧ����ȡ��ϩ�������¶ȹ��߶����������Ķ������������������ʵ����ȷ�������������������ϩ�Ͷ��������Իش��������⣮
ʵ����ͨ����Ũ������Ҵ���Ӧ����ȡ��ϩ�������¶ȹ��߶����������Ķ������������������ʵ����ȷ�������������������ϩ�Ͷ��������Իش��������⣮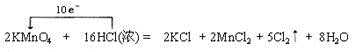 ���ڸ÷�Ӧ����������KMnO4���������ͻ�ԭ�������ʵ���֮��Ϊ1��5��������״����33.6LCl2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ3mol��
���ڸ÷�Ӧ����������KMnO4���������ͻ�ԭ�������ʵ���֮��Ϊ1��5��������״����33.6LCl2ʱ��ת�Ƶ��ӵ����ʵ���Ϊ3mol��