题目内容
4.随着卤素原子半径的增大,下列递变规律正确的是( )| A. | 单质氧化性逐渐增强 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 卤素离子的还原性逐渐增强 | D. | 气态氢化物稳定性逐渐增强 |
分析 卤族元素随着原子序数增大,其原子核外电子层数增多导致原子半径逐渐增大,
A.卤族元素氧化性随着原子序数增大而减弱;
B.卤族元素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比;
C.卤素元素的非金属性越强,其简单阴离子的还原性越弱;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:卤族元素随着原子序数增大,其原子核外电子层数增多导致原子半径逐渐增大,所以随着卤素原子半径的增大,其原子序数增大,
A.卤族元素原子半径越大,其原子核最最外层电子的吸引力减小,所以其单质的氧化性随着原子序数增大而减弱,故A错误;
B.卤族元素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,卤族元素随着原子序数增大其相对原子质量增大,所以其单质的熔沸点随着原子半径增大而增大,故B错误;
C.卤素元素的非金属性越强,其简单阴离子的还原性越弱,卤族元素非金属性随着原子半径增大而减弱,所以其简单阴离子的还原性随着原子半径增大而增强,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,卤族元素非金属性随着原子半径增大而减弱,所以其氢化物的稳定性随着原子半径增大而减弱,故D错误;
故选C.
点评 本题以卤族元素为例考查同一主族元素周期律,明确同一主族元素结构、性质关系,结构决定性质,性质体现结构,知道非金属性强弱比较方法,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
14.我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构简式如图所示:
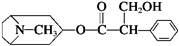
下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应,
其中错误的是( )

下列有关金丝桃素的说法:
①属于烃的衍生物,燃烧只产生CO2和H2O
②可以发生取代、加成、酯化、消去等反应
③分子式为C17H23O3N,苯环上的一氯取代物有3种
④1mol该物质最多能和6mol H2发生加成反应,
其中错误的是( )
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
15.下列化学用语正确的是( )
| A. | CH4分子的球棍模型: | B. | 羟基的电子式: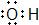 | ||
| C. | 醛基的结构简式:-CHO或HOC- | D. | 乙烯的实验式:CH2 |
12.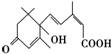 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )| A. | S-诱抗素含有碳碳双键、羟基、羰基、羧基 | |
| B. | S-诱抗素分子式为C16H18O2 | |
| C. | S-诱抗素能发生加成反应、水解反应、氧化反应 | |
| D. | 1mol S-诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
19.下列有关化学用语的表述正确的是( )
| A. | CCl4的电子式 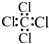 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
16.如果X、Y都是非金属元素,发生反应:2KXO3+Y2=2KYO3+X2下列叙述正确的是( )
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
13.下列说法中正确的是( )
| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
14.下列有关性质的比较中,正确的是( )
| A. | 热稳定性:H2S>HCl>HBr>HI | B. | 熔点:Na2O>MgO>CaO | ||
| C. | 微粒半径:F-<Na+<Mg2+ | D. | 还原性:H2S>HCl>HF |