题目内容
8.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )| A. | 2F2+2H2O═4HF+O2 | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O |
分析 根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,并利用化学反应方程式中的化学计量数来分析氧化剂与还原剂的物质的量之比.
解答 解:A.F2为氧化剂,H2O为还原剂,氧化剂和还原剂物质的量之比为1:1,故A错误;
B.为复分解反应,故B错误;
C.I2+2NaClO3=2NaIO3+Cl2中,氯元素的化合价降低,碘元素的化合价升高,则NaClO3为氧化剂,I2为还原剂,氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.反应4HCl+MnO2═MnCl2+Cl2↑+2H2O中,锰元素化合价由MnO2中+4价降低为MnCl2中+2价,MnO2是氧化剂,锰元素化合价全部降低;反应中氯元素化合价由HCl中-1价升高为Cl2中0价,HCl是还原剂,由方程式产物中氯元素化合价可知有$\frac{1}{2}$的HCl起还原剂作用,有$\frac{1}{2}$的HCl起酸作用,所以氧化剂与还原剂的物质的量之比为1:4×$\frac{1}{2}$=1:2,故D正确.
故选D.
点评 考查氧化还原反应基本概念与计算,难度不大,本题根据化学计量数判断氧化剂与还原剂关系,也可以根据电子转移守恒计算,注意D中氯化氢的作用.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
19.下列有关化学用语的表述正确的是( )
| A. | CCl4的电子式 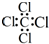 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
16.如果X、Y都是非金属元素,发生反应:2KXO3+Y2=2KYO3+X2下列叙述正确的是( )
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
3.已知反应2A(g)+B(g)?3C(g)+4D(g),则下列反应速率最快的是( )
| A. | v(A)=1mol/(L•s) | B. | v(B)=1.5mol/(L•s) | C. | v(C)=2mol/(L•s) | D. | v(D)=3mol/(L•s) |
13.下列说法中正确的是( )
| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
20.苯酚在一定条件下能与氢气加成得到环己醇.下面关于这两种有机物的叙述中,错误的是( )
| A. | 都能溶于水,但溶解性都比乙醇的差 | |
| B. | 都能与金属钠反应放出氢气 | |
| C. | 苯酚是比碳酸更强的酸,环己醇则显中性 | |
| D. | 苯酚与FeCl3溶液作用显紫色,环乙醇加入FeCl3溶液中无明显现象 |
17.下列离子方程式中书写正确的是( )
| A. | NaAlO2溶液滴入NaHCO3中:H++AlO2-+H2O=Al(OH)3↓ | |
| B. | 向FeI2溶液中滴加少量氯水:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 将2.24g铁粉投入400mL 0.3 mol/L的稀HNO3中:4Fe+12H++3NO3-=Fe3++3Fe2++3NO↑+6 H2O | |
| D. | 向含0.5 mol的明矾溶液中逐滴加入0.9 mol Ba(OH)2:5Al3++9SO42-+9Ba2++15OH-=9BaSO4↓+5Al(OH)3↓ |