题目内容
18.已知酸性大小:羧酸>碳酸>酚,下列含溴化合物中的溴原子,在适当条件下都能被羟其(-OH)取代(均可称之为水解反应),所得产物能跟NaHCO3溶液反应的是( )| A. | 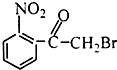 | B. | 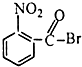 | C. | 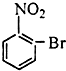 | D. | 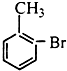 |
分析 酸性大小:羧酸>碳酸>酚,所以能和碳酸氢钠反应的官能团只能是-COOH,根据有机物水解后生成的官能团分析解答.
解答 解:酸性大小:羧酸>碳酸>酚,所以能和碳酸氢钠反应的官能团只能是-COOH,
A.该物质水解后生成醇-OH,生成物中没有-COOH,所以不能和碳酸氢钠反应,故A错误;
B.该物质水解后生成-COOH,所以有羧基,能和碳酸氢钠反应,故B正确;
C.该物质水解生成酚-OH,不能和碳酸氢钠反应,故C错误;
D.该物质水解生成酚-OH,不能和碳酸氢钠反应,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、醇、羧酸的性质,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
8.某结晶水合物的化学式为R•nH2O,其相对分子质量为M.25℃时,将a g该晶体溶于b g水中恰好可形成V mL饱和溶液.下列关系正确的是( )
| A. | 饱和溶液的物质的量浓度c=$\frac{1000a(M-18n)}{MV}$mol/L | |
| B. | 饱和溶液中溶质的质量分数w=$\frac{a(M-18n)}{M(a+b)}$% | |
| C. | 25℃时R的溶解度S=$\frac{100a(M-18n)}{18na+Mb}$g | |
| D. | 饱和溶液的密度ρ=$\frac{a(M-18n)}{a+b}$g/L |
6.下列各组物质混合反应后,既能生成气体,最终又能产生沉淀的是( )
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
| A. | 只有① | B. | 只有①② | C. | 除了③ | D. | 除了④ |
13.下列说法中正确的是( )
| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
10. 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )| A. | 在氢能的利用过程中,H2O可循环使用 | |
| B. | 开发和利用“氢能”,减少煤炭等化石能源的使用有助于控制臭氧空洞的形成 | |
| C. | 该法制氢的关键是寻找光分解催化剂 | |
| D. | 利用光电转化可将太阳能转化为电能用于电解水而获得氢气 |
7.下列反应的离子方程式正确的是( )
| A. | 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
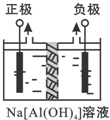 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: