题目内容
1.下列反应中,不能生成Al(OH)3沉淀的是( )| A. | 氧化铝和水 | B. | 三氯化铝和氨水 | ||
| C. | 氧化铝和强碱溶液 | D. | 铝和强碱溶液 |
分析 A.氧化铝不溶于水;
B.三氯化铝和氨水反应生成氢氧化铝和氯化铵;
C.氧化铝与强碱反应生成盐和水;
D.铝和强碱反应生成偏铝酸根离子和氢气.
解答 解:A.氧化铝不溶于水,则不能与水反应生成Al(OH)3,故A选;
B.三氯化铝和氨水反应生成氢氧化铝和氯化铵,故B不选;
C.氧化铝与强碱反应生成偏铝酸根离子和水,无Al(OH)3沉淀生成,故C选;
D.铝和强碱反应生成偏铝酸根离子和氢气,无Al(OH)3沉淀生成,故D选;
故选ACD.
点评 本题考查Al及其化合物的性质,为高频考点,把握氧化铝、氢氧化铝的两性为解答的关键,注意氧化铝不溶于水,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
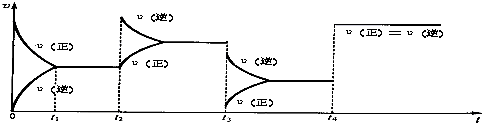
11.A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于非极性分子(填“极性”或“非极性”),化合物乙的电子式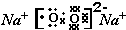 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
(3)元素B、D组成化合物丙,其晶体类型为离子晶体,化合物丙的溶液呈碱性(填“酸性”“碱性”或“中性”).
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高.
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65kJ 热量.则表示化合物丁的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.4KJ/mol.
②某实验小组依据丁燃烧的反应原理,设计如图所示的电池装置.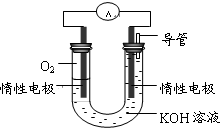
a.该电池正极的电极反应为O2+2H2O+4e-=4OH-.
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O.
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:BeO+2OH-=BeO22-+H2O.若E的氯化物熔沸点较低、易升华,则E的氯化物是共价化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择将其加热到熔融状态,做导电性实验,看其能否导电.
| 元素 | A | B | C | D | E | F |
性质或结构 信息 | 形成化合物种类最多的元素 | 最高正价是最低负价绝对值的3倍 | 族序数等于周期数的3倍 | 周期数是族序数的3倍 | 地壳中含量最高的金属元素 | 最高价氧化物对应水化物是最强的含氧酸 |
 元素F的最高价氧化物的化学式为Cl2O7.
元素F的最高价氧化物的化学式为Cl2O7.(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于非极性分子(填“极性”或“非极性”),化合物乙的电子式
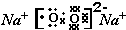 ,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.
,甲与乙反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2.(3)元素B、D组成化合物丙,其晶体类型为离子晶体,化合物丙的溶液呈碱性(填“酸性”“碱性”或“中性”).
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高.
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65kJ 热量.则表示化合物丁的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=890.4KJ/mol.
②某实验小组依据丁燃烧的反应原理,设计如图所示的电池装置.

a.该电池正极的电极反应为O2+2H2O+4e-=4OH-.
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为CH4+2O2+2OH-=CO32-+3H2O.
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式:BeO+2OH-=BeO22-+H2O.若E的氯化物熔沸点较低、易升华,则E的氯化物是共价化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择将其加热到熔融状态,做导电性实验,看其能否导电.
12.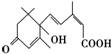 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
 已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )
已知在举国欢庆新中国60华诞之际,北京大街小巷对大量盆栽鲜花施用了S-诱抗素剂,以保证鲜花盛开,S-诱抗素的分子结构如图所示,下列关于该分子的说法正确的是( )| A. | S-诱抗素含有碳碳双键、羟基、羰基、羧基 | |
| B. | S-诱抗素分子式为C16H18O2 | |
| C. | S-诱抗素能发生加成反应、水解反应、氧化反应 | |
| D. | 1mol S-诱抗素在一定条件下可分别与4mol H2、2mol NaOH发生反应 |
16.如果X、Y都是非金属元素,发生反应:2KXO3+Y2=2KYO3+X2下列叙述正确的是( )
| A. | Y的金属性大于X | B. | Y2的还原性大于X2 | ||
| C. | Y的非金属性大于X | D. | Y2的氧化性大于X2 |
6.下列各组物质混合反应后,既能生成气体,最终又能产生沉淀的是( )
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
①金属钠投入到FeCl3溶液中
②Na2O2投入到CuSO4溶液中
③电石投入到过量NaHCO3溶液中
④在过量明矾溶液加入少量的Na2O.
| A. | 只有① | B. | 只有①② | C. | 除了③ | D. | 除了④ |
13.下列说法中正确的是( )
| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
10. 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
 能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )
能源在各个方面的重要作用,科学家预测“氢能”将是人类社会最理想的新能源,目前,有人提出一种最经济最理想的获得氢能源的循环体系,如图所示.下列说法错误的是( )| A. | 在氢能的利用过程中,H2O可循环使用 | |
| B. | 开发和利用“氢能”,减少煤炭等化石能源的使用有助于控制臭氧空洞的形成 | |
| C. | 该法制氢的关键是寻找光分解催化剂 | |
| D. | 利用光电转化可将太阳能转化为电能用于电解水而获得氢气 |