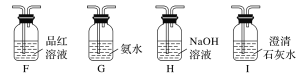
��Ŀ����
����Ŀ��ij�о�С���Ա�����ۼ���Ũ�����ϡ����ķ���ʱ���ռ������·�����
���� | ���� | |
�� | ����ֱ�������� | �����ΪŨ���� |
�� | �ֱ���������Ƭ | �����̼�����ζ��ΪŨ���� |
�� | �ֱ����ʢˮ���Թ��� | ������ΪŨ���� |
�� | �ֱ��� | �����ΪŨ���� |
(1)������______
(2)������һ�����������Ľ����ܳ�Ϊ���з�������______���Ľ�������______��
(3)������������ּ�������ɱ���
���� | ���� | |
A | __________ | ___________ |
B | ___________ | __________ |
���𰸡��ס������� �� ���� �ֱ������Ƭ ��������Ƭ�ܽ����ϡ���ᣬ���ܽ����Ũ���� �ֱ���ȡ��ͬ������� ���������Ũ����
��������
����Ũ�����ϡ�������õ��������������ϵIJ��죬�ȿ����Ũ��������Լ���Ҳ�������ϡ��������ʣ����ͨ�ԣ����𣬷�����������
(1)�ף�Ũ�����ܽ���ά���е�H��OԪ����2��1ˮ���ӵ���ʽ��ȥ��������ˮ�ԣ�ϡ����û����ˮ�ԣ�����ȷ��
�ң�Al��ϡ���ᷴӦ����������Ũ������������ۻ����ʴ���
����Ũ����ϡ�����зų��������ȣ�ϡ����û�����Ե���ЧӦ������ȷ��
����Ũ���������ˮ�ԣ�ϡ����û����ˮ�ԣ�����Ũ���ᡢϡ����ֱ�ӵ�CuSO4��5H2O �����У������ΪŨ���ᣬ����ȷ��
�ʴ�Ϊ���ס���������
(2)�ҷ��������������������У��������ܺ�ϡ���ᷴӦ��������������������Ũ����ۻ������ȲŻ���Ũ���ᷴӦ�ų�SO2���Ľ�����Ϊ���ȣ�
(3)��������ϡ�����Ũ������������죬�糣���£�������ϡ���ᷴӦ�ų����������ܽ⣻Ũ������ܶȴ���ϡ���ᣬŨ�������ˮ�Եȣ�����1��������Ƭ����������Ƭ�ܽ����ϡ���ᣬ���ܽ����Ũ�������2���ֱ���ȡ��ͬ������ᣬ���������Ũ�������3�����Գ�����������ϡ�����Ũ���ᣬ¶���ڿ����У��������ӵ���Ũ���ᣬ��֮����ϡ���ᡣ�������ɡ�

 �Ķ��쳵ϵ�д�
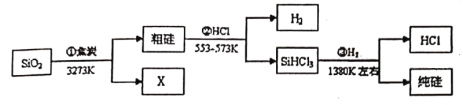
�Ķ��쳵ϵ�д�����Ŀ��ij���̿����Ҫ�ɷ�ΪMnCO3��������������FeCO3��CaCO3��MgCO3��Al2O3�Լ�һЩ����Ӧ�IJ��������ʣ���ҵ�������̿�Ϊԭ���Ʊ��ߴ���̼���̵�������ͼ��ʾ��

��֪��MnCO3+2NH4Cl![]() MnCl2+CO2��+2NH3��+H2O
MnCl2+CO2��+2NH3��+H2O
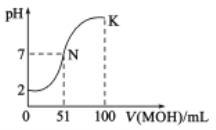
��ؽ�������[c0(Xn+)=0.1mol��L-1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
��ʼ����ʱ��pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
��ȫ����ʱ��pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
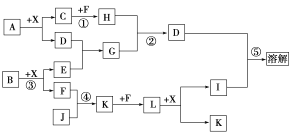
��1������¯�����ɵ�����A�ijɷ���__���ѧʽ����
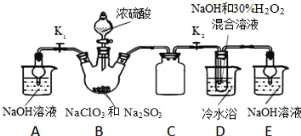
��2������A��������ȡ�������ȡ������ͼ��ʾ��
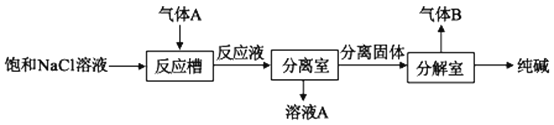
��Ӧ�����г����������ó�����__���ѧʽ�������ɸó��������ӷ�Ӧ����ʽΪ___������B�Ļ�ѧʽΪ___��
��3���������еij��Ӱ���������
�ټ�������MnO2��Fe2+ת��ΪFe3+���䷴Ӧ�����ӷ���ʽΪ___��
�ڼӰ�ˮ��pH=5.6�����ɵij����Ļ�ѧʽ��__��
�ۼ�������NH4F������Ϊ���ʵ�ʣ�����������ת��Ϊ������ˮ�ij�����ȥ��
��4������Һ�к��е�������Ҫ��__��