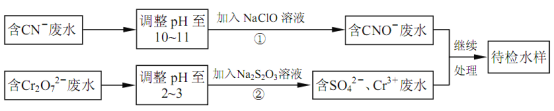
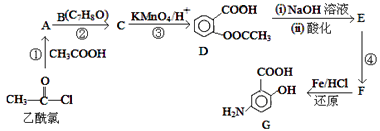
题目内容
【题目】很多含氯化合物都是重要的漂白剂
Ⅰ、亚氯酸钠(NaClO2)是一种常见漂白剂,某探究小组开展如下实验,回答下列问题:
制取NaClO2晶体按如下图装置进行制取。
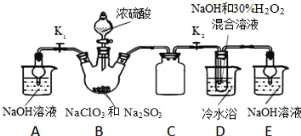
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是______;检验该离子的方法是____________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________。
Ⅱ、ClO2也是一种常见漂白剂,用ClO2处理过的饮用水常含有一定量有害的ClO![]() 。我国规定饮用水中ClO
。我国规定饮用水中ClO![]() 的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO
的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO![]() 的含量的过程如下:
的含量的过程如下:
①量取25.00 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-===2ClO![]() +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45 mL。此过程发生反应:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-。
+2I-。
④调节第③步所得溶液至pH≤2.0,此过程发生反应ClO![]() +4H++4I-===Cl-+2I2+2H2O。
+4H++4I-===Cl-+2I2+2H2O。
⑤再向溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液30.00 mL
根据上述数据计算并判断该水样中ClO![]() 的含量是否符合国家规定。
的含量是否符合国家规定。
______________。
【答案】防止D瓶溶液倒吸到B瓶中 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 SO42﹣ 取样,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣ 趁热过滤 NaClO3和NaCl 符合
【解析】
Ⅰ、装置B中制备得到ClO2,所以B中为NaClO3和Na2SO3在浓H2SO4的作用下生成ClO2和Na2SO4,反应方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;C可防止倒吸,起到安全瓶的作用;D中加入过氧化氢和氢氧化钠,在低温下与ClO2反应生成NaClO2,反应方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO23H2O,应趁热过滤;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl;
(5)由2ClO2+2I-===2ClO2-+I2和2S2O32-+I2===S4O62-+2I-得:2ClO2-~I2~2Na2S2O3,所以n(ClO2-) 生成= n(Na2S2O3)=1×10-3mol·L-1×7.45×10-3L=7.45×10-6 mol,
由ClO2-+4H++4I-===Cl-+2I2+2H2O和2S2O3-+I2===S4O6-+2I-得:ClO2-~2I2~4Na2S2O3,所以n(ClO2-) 总 = ![]() n(Na2S2O3) =
n(Na2S2O3) =![]() ×1×10-3 mol·L-1×30.00×10-3 L=7.50×10-6 mol,
×1×10-3 mol·L-1×30.00×10-3 L=7.50×10-6 mol,
原水样中c(ClO2-)=(7.50×10-6 mol-7.45×10-6 mol)÷0.025 L=2.00×10-6 mol·L-1,ClO2-的含量为2.00×10-6 mol·L-1×67.5×103 mg·mol-1=0.135 mg·L-1<0.2 mg·L-1,该水样中ClO2-的含量符合国家规定。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,收集了如下方案:
操作 | 结论 | |
甲 | 将火柴梗分别放入其中 | 变黑者为浓硫酸 |
乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
丙 | 分别加入盛水的试管中 | 放热者为浓硫酸 |
丁 | 分别在 | 变白者为浓硫酸 |
(1)其中可行的是______
(2)对其中一个操做稍做改进就能成为可行方案的是______,改进方法是______。
(3)请给出另外两种鉴别方案,完成表格。
操作 | 结论 | |
A | __________ | ___________ |
B | ___________ | __________ |