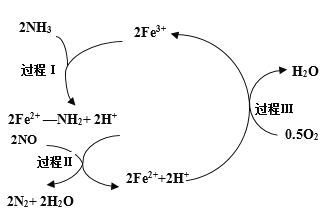
题目内容
【题目】某菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、MgCO3、Al2O3以及一些不反应的不溶性杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:

已知:MnCO3+2NH4Cl![]() MnCl2+CO2↑+2NH3↑+H2O
MnCl2+CO2↑+2NH3↑+H2O
相关金属离子[c0(Xn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Ca2+ | Mg2+ | Al3+ | Fe3+ |
开始沉淀时的pH | 8.1 | 6.3 | 10.6 | 8.9 | 3.4 | 1.5 |
完全沉淀时的pH | 10.1 | 8.3 | 13.1 | 10.9 | 4.7 | 2.8 |
(1)焙烧炉中生成的气体A的成分有__(填化学式)。
(2)气体A可用于制取纯碱,其制取过程如图所示:
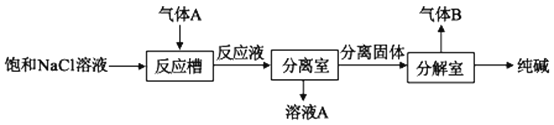
反应槽中有沉淀产生,该沉淀是__(填化学式),生成该沉淀的离子反应方程式为___,气体B的化学式为___。
(3)净化室中的除杂包含三步:
①加入少量MnO2将Fe2+转化为Fe3+,其反应的离子方程式为___;
②加氨水调pH=5.6,生成的沉淀的化学式是__;
③加入适量NH4F,将作为杂质的剩余金属阳离子转化为难溶于水的沉淀除去。
(4)净化液中含有的离子主要有__。
【答案】CO2、NH3和H2O NaHCO3 Na++NH3+CO2+H2O=NaHCO3↓+NH4+ CO2 4H++MnO2+2Fe2+=2Fe3++Mn2++2H2O Al(OH)3和Fe(OH)3 Mn2+、NH4+、Cl-
【解析】
(1)根据已知条件,菱锰矿经氯化铵混合焙烧之后生成CO2和NH3气体,又因反应体系温度过高,水以蒸汽的形式存在,故气体A主要含有CO2、NH3、H2O;
(2)将气体通入NaCl溶液中为侯氏制碱法的方程式,反应方程式为NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3↓,离子方程为:Na++NH3+CO2+H2O=NaHCO3↓+NH4+,故反应槽中的沉淀为NaHCO3,将固体进入分解室加热,NaHCO3受热分解,生成Na2CO3和CO2,故气体B为CO2;
(3)①向溶液中加入MnO2,在酸性条件下可将Fe2+氧化为Fe3+,方程式为4H++MnO2+2Fe2+=2Fe3++Mn2++2H2O;
②加氨水调节溶液pH,当pH大于离子开始沉淀pH时,这种离子开始生成沉淀,故沉淀为Al(OH)3和Fe(OH)3;
(4)浸取液进入净化室后,调节pH至5.6保证Fe3+、Al3+除尽,加入NH4F将Ca2+、Mg2+除尽,此时溶液中含有的阳离子为Mn2+和NH4+,阴离子为Cl-。

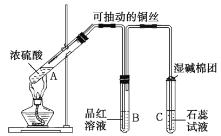
【题目】某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,收集了如下方案:
操作 | 结论 | |
甲 | 将火柴梗分别放入其中 | 变黑者为浓硫酸 |
乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
丙 | 分别加入盛水的试管中 | 放热者为浓硫酸 |
丁 | 分别在 | 变白者为浓硫酸 |
(1)其中可行的是______
(2)对其中一个操做稍做改进就能成为可行方案的是______,改进方法是______。
(3)请给出另外两种鉴别方案,完成表格。
操作 | 结论 | |
A | __________ | ___________ |
B | ___________ | __________ |