题目内容
【题目】常温下,向50mL0.01mol·L-1的HA溶液中逐滴加入0.01mol·L-1的MOH溶液,混合溶液pH的变化与所加MOH溶液的体积关系如图所示(密度引起的体积变化忽略不计),下列说法正确的是( )
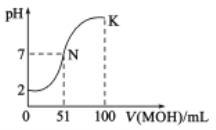
A.由图无法判断HA是强酸还是弱酸
B.混合溶液的pH=7时,HA与MOH恰好完全反应
C.K点对应的溶液中,c(M+)>c(OH-)>c(A-)>c(H+)
D.当加入MOH溶液的体积为50mL时,溶液中:c(H+)=c(MOH)+c(OH-)
【答案】D
【解析】
A.从图像上可以看出,不加MOH时,溶液pH=2,此时溶液中氢离子浓度与酸浓度相同,说明酸完全电离,说明HA是强酸,A错误;
B.酸、碱溶液浓度相同,当二者恰好完全反应时,说明二者溶液的体积相同,此时溶液中溶质为MA,,是强酸弱碱盐,呈酸性,pH<7,B错误;
C.K点为MA和MOH的混合溶液,由于M为弱碱阳离子,在溶液中水解,故溶液中的氢氧根浓度小于A离子浓度,C错误;
D.当加入50mL MOH时,酸碱完全发生反应,溶质为MA,可以得出溶液的质子守恒式c(H+)=c(MOH)+c(OH-),D正确;
故选D。

 阅读快车系列答案
阅读快车系列答案【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A(g)和B(g),发生反应:2A(g)+B(g)![]() 2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
2C(g)。一段时间后反应达到平衡状态,反应过程中测定的部分数据如下表所示:
反应时间/min | n(A)/mol | n(B)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法错误的是()
A.前5min的平均反应速率为v(A)=0.08mol·L-1·min-1
B.降低温度为T2℃时,测得上述反应的平衡常数为20,则正反应为吸热反应
C.保持温度不变,向平衡后的容器中再充入0.2molA(g)和0.2molB(g)时,v(正)>v(逆)
D.相同温度下,若起始时向容器中充入0.2molC(g),达到平衡状态时C的转化率为40%
【题目】某研究小组成员在讨论鉴别浓硫酸和稀硫酸的方案时,收集了如下方案:
操作 | 结论 | |
甲 | 将火柴梗分别放入其中 | 变黑者为浓硫酸 |
乙 | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
丙 | 分别加入盛水的试管中 | 放热者为浓硫酸 |
丁 | 分别在 | 变白者为浓硫酸 |
(1)其中可行的是______
(2)对其中一个操做稍做改进就能成为可行方案的是______,改进方法是______。
(3)请给出另外两种鉴别方案,完成表格。
操作 | 结论 | |
A | __________ | ___________ |
B | ___________ | __________ |