题目内容
6.已知:99℃时,Kw=1.0×10-12.在该温度下,测得0.1mol.L-1 Na2A溶液pH=6.则下列说法正确的是( )| A. | H2A在水溶液中的电离方程式为:H2A?2H++A2- | |
| B. | 0.1mol.L-1的H2A溶液pH<2 | |
| C. | 体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2多 | |
| D. | (NH4)2 A溶液中存在离子浓度关系:c(A2- )>C(NH4+ )>C(H+ )>C(OH- ) |
分析 99℃时,KW=1.0×10-12,则该温度下纯水中c(H+)=$\sqrt{{K}_{W}}$=1.0×10-6mol/L,纯水的pH=6;在该温度下,测得0.1mol•L-1Na2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,
A.H2A为强电解质,在溶液中完全电离,电离方程式用等号;
B.0.1mol/L的H2A溶液中氢离子浓度为0.2mol/L;
C.H2A和氯化氢都是强电解质,则溶液体积、pH相等的两溶液中氢离子的物质的量相等,与足量锌反应生成氢气量相等;
D.铵根离子的水解程度减小,则c(NH4+)>c(A2-).
解答 解:99℃时,KW=1.0×10-12,则该温度下纯水中c(H+)=$\sqrt{{K}_{W}}$=1.0×10-6mol/L,纯水的pH=6;在该温度下,测得0.1mol•L-1Na2A溶液pH=6,溶液呈中性,说明Na2A是强酸强碱盐,则H2A是强酸,
A.通过以上分析知H2A为强酸,其电离方程式为:H2A=2H++A2-,故A错误;
B.0.lmol•L-l的H2A溶液中c(H+)=0.2mol/L,该溶液的pH<2,故B正确;
C.体积相等pH=1的盐酸与H2A溶液中含有氢离子的物质的量相等,锌足量,则反应生成的氢气的量相等,故C错误;
D.(NH4)2A为强酸弱碱盐,铵根离子水解导致溶液呈酸性,铵根离子水解程度较小,所以溶液中存在离子浓度关系:c(NH4+)>c(A2-)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,根据该温度下水的离子积判断pH=6的溶液为中性溶液为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒在判断离子浓度大小中的应用方法,试题侧重考查学生的分析、理解能力.

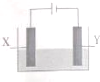 探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是
探究电解精炼铜(粗铜含有Ag、Zn、Fe)和电化学腐蚀装置如图,下列叙述正确的是( )
| A. | 精炼铜时,电解质为硫酸铜溶液.Y电极反应为:Cu2++2e+=Cu | |
| B. | 精炼铜时,溶液中Ag+、Zn2+、Fe2+浓度增大 | |
| C. | X电极为石墨,Y电极为Cu,则铜收到保护 | |
| D. | X电极为Fe,Y电极为Cu,则铁收到保护 |
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(2)C的原子结构示意图为
 ,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
,C单质与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.(3)D的单质与A的一种氢化物反应生成具有漂白性的物质,反应的化学方程式为:Cl2+H2O=HCl+HClO.
(4)D的最高价氧化物对应的水化物的分子式为HClO4,其酸性比H2SO4强(填“强”或“弱”).
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 向溶液中滴加少量氯水,再滴加KSCN溶液 | 溶液变红 | 证明溶液中含有Fe2+ |
| B | 用铜与稀硫酸检验溶液中的 NO3- | 加热后,试管口有红棕色气体产生 | 硝酸根离子在酸性条件下与铜反应生成NO2 |
| C | 将铝箔放在火焰上灼烧 | 熔化物悬挂不下落 | 铝表面生成高熔点氧化铝未熔化 |
| D | 用盐酸标准液滴定未知浓度的Na2CO3溶液 | 分别用甲基橙和酚酞做指示剂时消耗盐酸的体积相等 | 标准液的用量只与待测液的物质的量有关,与指示剂无关 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 常温下,0.05mol•L1Fe2(SO4)3溶液中含Fe3+数目小于0.1NA | |
| B. | 30g甲醛中含4NA对电子 | |
| C. | 7.8g过氧化钠中含有0.1NA个阴离子 | |
| D. | 标准状况下,22.4L乙烷含有的分子数为NA |
| A. | 该实验表明SO2有漂白性 | B. | 白色沉淀为BaSO3 | ||
| C. | 该实验表明FeCl3有还原性 | D. | 反应后溶液酸性增强 |
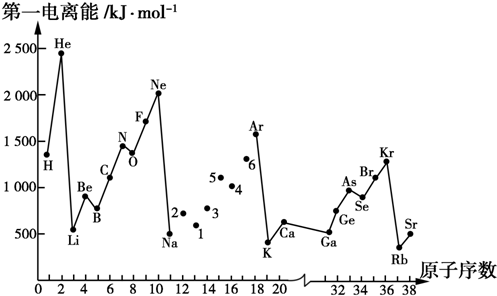
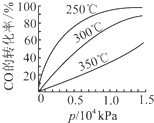 强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
强的关系如图所示.实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.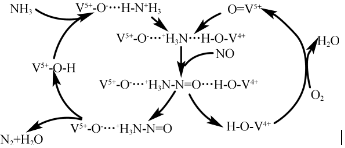
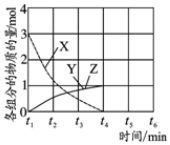
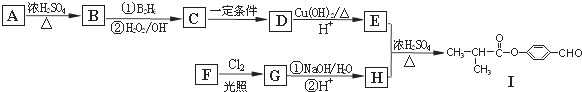
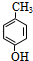 .
. .E与H反应生成I的方程式为
.E与H反应生成I的方程式为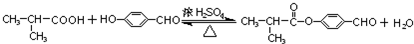 .
.