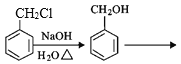
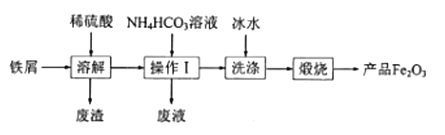
题目内容
【题目】摩尔盐是一种重要的化工原料,化学组成可表示为x(NH4)2SO4yFeSO4zH2O。
为确定摩尔盐的组成,进行如下实验:
步骤一:称取一定量的新制摩尔盐,溶于水配制成100.00mL溶液A。
步骤二:准确量取25.00mL溶液A,加入足量BaCl2溶液,充分反应后过滤、洗涤、干燥,得白色固体2.330g。
步骤三:另取25.00mL溶液A,加入0.05000molL-1KMnO4酸性溶液,发生反应:Fe2++MnO4-+H+→Fe3++Mn2++H2O(未配平),当两者恰好完全反应时,消耗KMnO4溶液的体积为20.00mL。
(1)步骤一中,必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和___。
(2)检验溶液A中含有NH4+的实验方法是___。
(3)步骤二中,证明所加BaCl2溶液己经过量的实验方法为___。
(4)通过计算确定摩尔盐中x:y的值___(写出计算过程)。
【答案】100mL容量瓶 取少量溶液A,加入氢氧化钠溶液,加热,产生的气体若能使湿润红色石蕊试纸变蓝,则说明溶液中含有铵根离子 取上层清液,继续滴加氯化钡溶液,若不出现白色沉淀,则说明氯化钡已加过量 1:1
【解析】
⑴配制溶液应该用100mL的容量瓶进行配制;
⑵检验铵根时要先加氢氧化钠溶液,再加热;
⑶验证加入物质是否过量,则向取上层清液中再继续加检验试剂,看是否有沉淀生成;
⑷先算出硫酸根的物质的量,再计算出亚铁离子的物质的量,再算x,最后得出比例关系。
⑴步骤一中,配制100mL溶液必须使用到的玻璃仪器有玻璃棒、胶头滴管、烧杯和100mL容量瓶;
⑵检验溶液A中含有NH4+的实验方法是取少量溶液A,加入氢氧化钠溶液,加热,产生的气体若能使湿润红色石蕊试纸变蓝,则说明溶液中含有铵根离子;
⑶步骤二中,证明所加BaCl2溶液己经过量,即证明溶液中是否含有SO42-,实验方法是取上层清液与试管,继续滴加BaCl2溶液,若不出现白色沉淀,则说明BaCl2已加过量;
⑷25mL溶液中生成了2.33g硫酸钡沉淀即物质的量![]() ,再根据关系式
,再根据关系式![]() ,n(Fe2+)=5n(MnO4-) = 5×0.05000molL-1×0.02L = 0.005mol,x + y =0.01mol,y=0.005mol,则x=0.005mol,因此x:y=1:1。
,n(Fe2+)=5n(MnO4-) = 5×0.05000molL-1×0.02L = 0.005mol,x + y =0.01mol,y=0.005mol,则x=0.005mol,因此x:y=1:1。

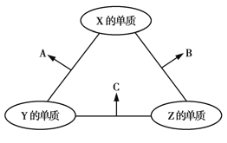
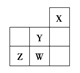
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______