题目内容
19.25℃,AgI饱和液中c(Ag+)为1.22×10-8mol?L-1,AgCl饱和液中c(Ag+)为1.30×10-5mol?L-1.若在5mL含有KCl和KI浓度均为0.01mol?L-1的混合溶液中,滴加8mL 0.01mol?L-1的AgNO3溶液,则下列叙述中不正确的是( )| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
分析 A.根据溶解度判断沉淀的先后顺序,利用溶度积常数计算出各离子浓度;结合反应的程度比较溶液离子浓度的大小;
B.依据碘化银和氯化银溶度积比较溶解度可知,碘化银溶解度小,反应中先析出碘化银;
C.AgCl饱和溶液中c(Ag+)为1.30×10-5mol•L-1.溶液中存在沉淀溶解平衡AgCl(s)?Ag++Cl-,氯离子浓度为1.30×10-5mol•L-1;依据Ksp=[Ag+][Cl-]计算得到;
D.依据氯化银和碘化银的溶度积比较溶解度,反应向更难溶的方向进行.
解答 解:A.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/L AgNO3溶液,首先生成AgI沉淀,反应后剩余n(Ag+)=0.003L×0.01mol/L=3×10-5mol,继续生成AgCl沉淀,反应后剩余氯离子的物质的量为:n(Cl-)=0.005×0.01mol/L-3×10-5mol=2×10-5mol,
c(Cl-)=2×10-5mol÷0.013L=1.53×10-3mol/L,
浊液中c(Ag+)=$\frac{1.30×1{0}^{-5}×1.30×1{0}^{-5}}{1.53×1{0}^{-3}}$mol/L=1.1×10-7mol/L,
c(I-)=$\frac{1.22×1{0}^{-8}×1.22×1{0}^{-8}}{1.1×1{0}^{-7}}$mol/L=1.35×10-9mol/L,
c(NO3-)=$\frac{0.01mol/L×0.008L}{0.013L}$=0.006mol/L,故c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故A错误;
B.碘化银的溶度积较小,则溶液中先产生的是AgI沉淀,故B正确;
C.AgCl饱和溶液中c(Ag+)为1.30×10-5mol•L-1,溶液中存在沉淀溶解平衡AgCl(s)?Ag++Cl-,氯离子浓度为1.30×10-5mol•L-1,由Ksp=[Ag+][Cl-]=1.30×10-5mol/L×1.30×10-5mol/L=1.69×10-10,故C正确;
D.碘化银比氯化银更难溶,则在AgCl悬浊液中滴加KI溶液,白色的氯化银沉淀会转变成黄色的碘化银沉淀,故D正确;
故选A.
点评 本题考查了难溶物的沉淀溶解平衡的计算及判断,题目难度中等,根据溶度积计算混合溶液中离子浓度是解题关键,试题侧重考查学生的分析能力及化学计算能力.

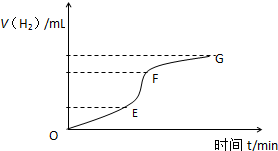 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:(1)如图为氢气与反应时间关系图,分析判断EF段化学反应速率最快,最快的原因是该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快.
(2)某学生在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值且气体体积均转化为标准状况下体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是AC.
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(4)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)降低温度.
| A. | A和B可形成AB32-、A2B42-等离子 | |
| B. | B的氢化物的沸点低于C的氢化物的沸点 | |
| C. | 单质C的晶体中含有共价键和范德华力 | |
| D. | 由A、D形成的一种物质可用以提取碘水中碘单质 |
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
(2)将含Cu与CuO的混合物20.8g加入到50mL 18.4mol•L-1的浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000mL,测得溶液中c(Cu2+)=0.3mol•L-1.试计算:
①反应放出的气体在标准状况下的体积(不考虑气体的溶解)是4.48L.
②稀释后的溶液中含有的c(H+)是0.84mol/L.
| A. | 离子化合物一定不含共价键 | |
| B. | 共价化合物一定不含离子键 | |
| C. | 气态单质的分子中一定存在共价键 | |
| D. | 非金属元素的化合物一定不含离子键 |
