题目内容
4.在Na2C2O4溶液中,存在多种分子和离子,下列关系中不正确的是( )| A. | c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | c(Na+)=2c(HC2O4-)+2c(H2C2O4)+2c(C2O42-) | |
| C. | c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4) | |
| D. | c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) |
分析 盐Na2C2O4的溶液中C2O42-水解呈碱性,
A、结合电荷守恒分析,阴阳离子所带电荷数相同,电性相反;
B、依据物料守恒判断,n(Na)=2n(C2O42-);
C、Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),c(Na+)+c(H+)=c(OH-)+c(HC2O4--)+2c(C2O42-),二者联立分析判断;
D、草酸根离子分步水解溶液显碱性.
解答 解:A、由电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故A错误;
B、由物料守恒可知,Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),故B正确;
C、Na2C2O4溶液中存在c(Na+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4),电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),二者联式可得Na2C2O4溶液中存在c(HC2O4-)+2c(H2C2O4)+c(H+)=c(OH-),c(OH-)-c(HC2O4-)=c(H+)+2c(H2C2O4),故C正确;
D、草酸根离子分步水解溶液显碱性,溶液中离子浓度大小为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故D正确;
故选A.
点评 本题考查离子浓度的大小比较,题目难度中等,注意把握电解质的电离和盐类水解原理,结合守恒的方法解答该题.

练习册系列答案
相关题目
15.下列关于电离度α的叙述中,正确的是( )
①α与浓度无关 ②α值随温度升高而增大 ③在相同条件下,α值的大小可以表示弱电解质的相对强弱 ④α值越大,相应离子浓度一定就越大 ⑤α值增大,相应离子的物质的量一定增大 ⑥在相同条件下,浓度相同的酸,α越大,其酸性也越强.
①α与浓度无关 ②α值随温度升高而增大 ③在相同条件下,α值的大小可以表示弱电解质的相对强弱 ④α值越大,相应离子浓度一定就越大 ⑤α值增大,相应离子的物质的量一定增大 ⑥在相同条件下,浓度相同的酸,α越大,其酸性也越强.
| A. | ①②③ | B. | ①④⑥ | C. | ②③⑥ | D. | ③④⑤ |
12.下列过程中,破坏的作用力相同的是( )
| A. | HCl溶于水和NaCl溶于水 | B. | 干冰升华和碘升华 | ||
| C. | NH4Cl受热分解和HI受热分解 | D. | 石英熔化和冰熔化 |
19.25℃,AgI饱和液中c(Ag+)为1.22×10-8mol?L-1,AgCl饱和液中c(Ag+)为1.30×10-5mol?L-1.若在5mL含有KCl和KI浓度均为0.01mol?L-1的混合溶液中,滴加8mL 0.01mol?L-1的AgNO3溶液,则下列叙述中不正确的是( )
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
16.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2甲.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图2乙中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 90.0 |

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.
14.X和Y是短周期元素,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+11 | B. | n-5 | C. | n+3 | D. | n+5 |

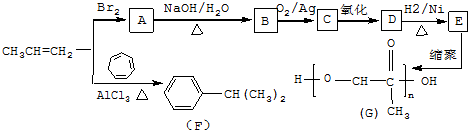
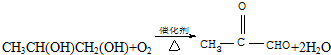 ,C发生银镜反应的化学方程式
,C发生银镜反应的化学方程式 .
.
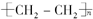 ?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.
?+3nO2$\stackrel{点燃}{→}$2nCO2+2nH2O.