题目内容
11.下列说法正确的是( )| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
分析 A.利用电解熔融的氯化镁来冶炼金属Mg;
B.浓硫酸与铁反应发生钝化,且不生成氢气;
C.电解饱和食盐水时,阴极上氢离子放电,从而促进水的电离;
D.纯银器在空气中露置其表面被氧化为氧化银
解答 解:A.利用电解熔融的氯化镁来冶炼金属Mg,而电解MgCl2饱和溶液生成氢氧化镁沉淀、氢气、氯气,故A错误;
B.浓硫酸与铁反应发生钝化,且不生成氢气,不能增大生成氢气的反应速率,故B错误;
C.电解饱和食盐水时,阴极上析出氢气,从而促进水的电离,则水的电离平衡正向移动,故C正确;
D.纯银器在空气中露置其表面被氧化为氧化银,属于化学腐蚀,故D错误;
故选C.
点评 本题考查原电池和电解原理,注重对理论与生活、生产的联系,体现了化学的学以致用,题目难度不大.

练习册系列答案
相关题目
2.能促使水的电离平衡右移,并使溶液中的c(H+)>c(OH-)的操作是( )
| A. | 向水中通入二氧化硫气体 | B. | 向水中加入少量氯化铁固体 | ||
| C. | 将水加热煮沸 | D. | 向水中加入碳酸钠晶体 |
19.25℃,AgI饱和液中c(Ag+)为1.22×10-8mol?L-1,AgCl饱和液中c(Ag+)为1.30×10-5mol?L-1.若在5mL含有KCl和KI浓度均为0.01mol?L-1的混合溶液中,滴加8mL 0.01mol?L-1的AgNO3溶液,则下列叙述中不正确的是( )
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |
6.常温下,向10ml pH=10 的NaOH 溶液中逐滴加入 pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后溶液体积不变即溶液体积能简单相加),则对反应后溶液的叙述正确的是( )
| A. | c(A-)>c(Na+) | B. | c(H+)=c(OH-)<c(Na+)<c(A-) | ||
| C. | V(混)≥20mL | D. | V(混)≤20mL |
16.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
(1)请完成以下实验设计表(表中不要留空格):
(2)编号①实验测得容器中压强随时间变化如图2甲.t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀,请在图2乙中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了还原(填“氧化”或“还原”)反应,其电极反应式是O2+2H2O+4e-=4OH-.

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.
(1)请完成以下实验设计表(表中不要留空格):
| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 90.0 |

(3)该小组对图2甲中0-t1时压强变大的原因提出了如下假设,请你完成假设二::
假设一:发生析氢腐蚀产生了气体;
假设二:反应放热使锥形瓶内温度升高;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案,请你再设计一个实验方案验证假设一.
3.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1 L 0.1 mol•L-1 CH3COOH溶液中含有的CH3COO-为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中含有的氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2,同时转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中含有的共用电子对的数目为6NA |
 请在该方程式中标明电子转移的方向和数目
请在该方程式中标明电子转移的方向和数目
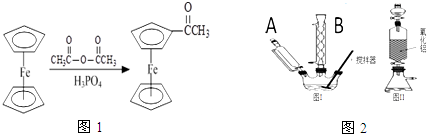
 ),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)
),可以使用的仪器分析方法是质谱法(或核磁共振氢谱).(写一种即可)