题目内容
9.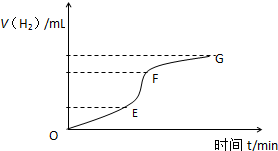 用纯净的锌粒与稀盐酸反应制取氢气,请回答:
用纯净的锌粒与稀盐酸反应制取氢气,请回答:(1)如图为氢气与反应时间关系图,分析判断EF段化学反应速率最快,最快的原因是该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快.
(2)某学生在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值且气体体积均转化为标准状况下体积):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是AC.
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(4)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)降低温度.
分析 (1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快;溶液浓度、温度都增大反应速率;
(2)根据v=$\frac{△c}{△t}$计算;
(3)减小反应物浓度能减缓反应速率;
(4)还可以采用降低温度的方法减缓反应速率
解答 解:(1)反应速率=$\frac{△c}{△t}$,所以曲线的斜率越大,其反应速率越快,所以反应速率最快的是EF段;溶液浓度、温度都增大反应速率,因为该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快,
故答案为:EF;该反应是放热反应,随着溶液的进行,溶液温度升高,溶液浓度虽然较小,但温度影响大于浓度影响,所以反应速率快;
(2)2~3min时间段生成氢气体积为232ml-120mL=112mL,n(H2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则消耗n(HCl)=0.01mol,v=$\frac{△c}{△t}$=$\frac{\frac{0.01mol}{0.1L}}{1min}$=0.1mol.L-1.min-1,
故答案为:0.1mol.L-1.min-1;
(3)减小反应物浓度能减缓反应速率,
A.加入蒸馏水,降低酸浓度,所以反应速率减缓,故正确;
B.加入氯化钠固体,酸浓度不变,所以反应速率不变,故错误;
C.加入氯化钠溶液,溶液体积增大,酸浓度降低,所以减缓反应速率,故正确;
D.加入浓盐酸,酸浓度增大,反应速率加快,故错误;
故选AC;
(4)还可以采用降低温度的方法减缓反应速率,故答案为:降低温度.
点评 本题考查化学反应速率计算及其影响因素,为高频考点,温度、浓度、催化剂、反应物接触面积等都影响反应速率,难点是(1)题图象分析,知道曲线斜率的含义.

 阅读快车系列答案
阅读快车系列答案| A. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| B. | 向海水中加入净水剂明矾可以使海水淡化 | |
| C. | 福尔马林可浸制标本,利用了其使蛋白质变性的性质 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
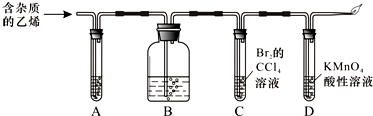
| A. | 乙烯通入酸性高锰酸钾溶液,发生取代反应 | |
| B. | 向试管中加入2mL5%硫酸铜溶液,再滴加几滴稀氢氧化钠溶液,混匀,立即加入2mL10%葡萄糖溶液,在酒精灯上加热至沸腾,可看到红色沉淀 | |
| C. | 用蒸馏法分离乙酸乙酯和饱和碳酸钠溶液 | |
| D. | 煤的干馏、煤的气化、石油裂化是化学变化,石油的分馏是物理变化 |
| A. | 乙烯的结构简式:CH2CH2 | B. | 过氧化氢的电子式: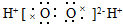 | ||
| C. | NH3的电子式: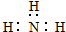 | D. | 乙酸的球棍模型: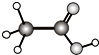 |
| A. | 乙烯发生加聚反应制得聚乙烯高分子材料 | |
| B. | 用甲烷与氯气制备一氯甲烷 | |
| C. | 用苯和浓硫酸、浓硝酸为原料制取硝基苯 | |
| D. | 用石灰石和稀盐酸反应制得二氧化碳 |
| A. | 反应后溶液中离子浓度大小关系为:c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 溶液中先产生的是AgI沉淀 | |
| C. | AgCl的KSP的数值为1.69×10-10 | |
| D. | 若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀 |

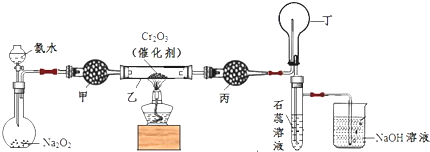
 请在该方程式中标明电子转移的方向和数目
请在该方程式中标明电子转移的方向和数目