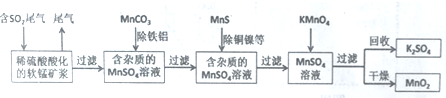
题目内容
9.粗铜精炼后的阳极泥中含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下: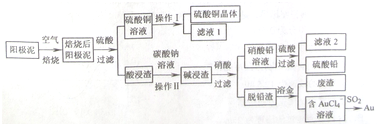
(1)电解精炼含铜、金、铅的粗铜时,电解液应该用CuSO4溶液作电解液,电解时阳极的电极反应式为Pb-2e-+SO42-=PbSO4和Cu-2e-=Cu2+.
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是将阳极泥粉碎,逆流焙烧等,焙烧后的阳极泥中除含金、PbSO4外,还有CuO(填化学式).
(3)完成操作I的主要步骤:蒸发浓缩,降温结晶,过滤,洗涤,干燥.
(4)写出用SO2还原AuC14一的离子反应方程式2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+.
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法用滤液2溶解碱浸渣.
(6)用离子方程式表示加入碳酸钠溶液的作用PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).(已知298K时,Ksp(PbCO3)=l.46×l0-13,Ksp(PbSO4)=l.82×l0-8)
分析 粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au.
(1)电解精炼粗铜时一般用硫酸铜溶液作电解质溶液,粗铜中的铜和铅会发生失电子的氧化反应,据此回答;
(2)阳极泥的成分为Cu、Au(金)和PbSO4 等,在焙烧过程中铜被氧化为了CuO,根据阳极泥充分的粉碎,增大接触面积可以提高焙烧效率来回答;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,操作II是从酸浸渣(PbSO4)中得到碱浸渣(PbCO3),据此回答;
(4)SO2还原AuCl4-反应得到氧化产物是SO42-,还原产物是Au,配平书写方程式;
(5)将滤液1并入硫酸铜溶液进行循环操作,有利于充分利用,据此回答;
(6)碳酸铅比硫酸铅更加难溶,往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应.
解答 解:粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,焙烧后金属铜成为氧化铜,酸浸可以得到硫酸铜溶液,硫酸铜溶液经过蒸发浓缩,降温结晶,过滤、洗涤,干燥获得硫酸铜晶体;Au(金)和PbSO4等杂质经碳酸钠浸洗、浓硝酸氧化后,过滤得到硝酸铅溶液,滤液加硫酸生成硫酸铅沉淀,再过滤得到硫酸铅;脱铅滤渣主要是金,加王水溶金,得到含有AuCl4-的溶液,AuCl4-可以被SO2还原得到Au.
(1)电解精炼粗铜时一般用硫酸铜溶液作电解质溶液;电解精炼的粗铜作阳极会发生氧化反应,其中单质铜和活泼性比Cu强的金属都会发生溶解,因此粗铜中的铜和铅会发生失电子的氧化反应,电极反应式为:Pb-2e-+SO42-=PbSO4,
故答案为:CuSO4;Pb-2e-+SO42-=PbSO4;
(2)由题干可知,用于焙烧的阳极泥的成分为Cu、Au(金)和PbSO4 等,所以在焙烧过程中铜被氧化为了CuO,而Au(金)和PbSO4 均较稳定,要使焙烧效率提高,合理措施是把得到的阳极泥充分的粉碎,增大接触面积,或把反应后的气体在次逆流焙烧,这样可以升高温度且减少能耗,
故答案为:将阳极泥粉碎,逆流焙烧等; CuO;
(3)操作I的步骤是从硫酸铜溶液中获得硫酸铜晶体,因此该步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤,操作II是从酸浸渣(PbSO4)中得到碱浸渣(PbCO3),因此该操作是过滤操作.
故答案为:蒸发浓缩,降温结晶;
(4)SO2还原AuCl4-中还原剂和氧化剂都比较明确,因此很容易推测出氧化产物是SO42-,还原产物是Au,根据氧化还原反应得失电子守恒先缺项配平,然后根据电荷守恒再配平,因此得到的反应方程式为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
故答案为:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+;
(5)滤液1是在结晶硫酸铜时剩下的滤液,还含有少量的未析出的硫酸铜,因此并入前面的硫酸铜溶液进行循环,有利于充分利用,因此类似此处的做法,应该是流程中得到的另一滤液2,此滤液2是在硝酸铅溶液中加入硫酸生成硫酸铅沉淀并过滤走硫酸铅后剩下的溶液,此溶液中H+没有发生反应,因此还有大量的硝酸溶液,所以可以把此滤液当成硝酸加入前面的碱浸渣中溶解碱浸渣;
故答案为:用滤液2溶解碱浸渣;
(6)通过比较两种沉淀的溶度积,可以看出碳酸铅比硫酸铅更加难溶,因此往硫酸铅中加入碳酸钠,发生的是沉淀溶解转化的反应,离子方程式要注意标明状态,方程式为:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
故答案为:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).
点评 本题主要考查了物质的分离、离子的检验、电解原理的应用、沉淀的转化等知识,侧重于考查学生对基础知识的综合应用能力,是一道能力提升题,题目难度较大.

①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
| A. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 |
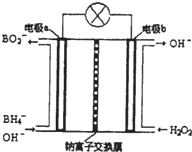 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题: