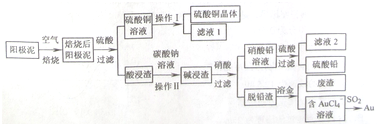
题目内容
15.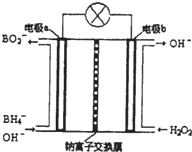 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:(1)电极a上发生的电极反应式为BH4-+8OH--8e-=BO2-+6H2O.
(2)电池工作时,Na+向的移动方向是从a极区移向b极区,常温下当左槽产生0.0125mol BO2-离子时,右槽NaOH溶液pH=13.
分析 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电解质溶液呈碱性,由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,结合原电池的工作原理和电子守恒以及pH的计算来解答.
解答 解:(1)根据图示内容,正极bH2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,负极a发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故答案为:BH4-+8OH--8e-=BO2-+6H2O;
(2)原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,根据电极反应:BH4-+8OH--8e-=BO2-+6H2O,当左槽产生0.0125mol BO2-离子时,转移电子是0.1mol,此时根据正极上电极反应H2O2+2e-=2OH-,则生成氢氧根离子的物质的量是0.1mol,则氢氧根离子浓度是0.1mol/L,所以pH=13,
故答案为:从a极区移向b极区;13.
点评 本题考查原电池工作原理,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
5.下列实验一定能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
6.下列关于苯的说法中,正确的是( )
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
3.分子式为C6H12O2且与NaHCO3反应放出CO2的有机化合物有(不考虑立体结构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
20.已知,金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据,下列选项中正确的是:
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
7.相同条件下,用下列物质做氧化剂收集相同Cl2消耗浓盐酸最多的是( )
| A. | MnO2 | B. | KMnO4 | C. | NaClO | D. | KClO3 |
4.BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
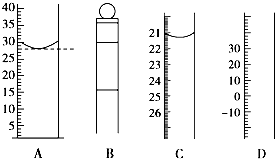 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)