题目内容
19.应用元素周期律分析,下列推断正确的是( )| A. | 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱 | |
| B. | 砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl | |
| C. | 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 | |
| D. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 |
分析 A.根据元素周期表中同周期元素性质的变化规律来比较金属性,金属性越强,则最高价氧化物对应水化物的碱性越强;
B.同主族从上到下氢化物的稳定性减弱;
C.氨气溶于水显碱性;
D.同主族从上到下金属性增强.
解答 解:A.第三周期金属元素随原子序数的增大金属性减弱,金属性Na>Mg>Al,则金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱,故A正确;
B.同主族从上到下氢化物的稳定性减弱,则砹的氢化物的稳定性小于HCl,故B错误;
C.第2周期非金属元素的气态氢化物中氨气溶于水生成一水合氨,溶液显碱性,故C错误;
D.同主族从上到下金属性增强,铊的金属性比铝强,则铊只能与盐酸反应,不与氢氧化钠反应,故D错误.
故选A.
点评 本题考查元素周期表中同周期和同主族元素的性质变化规律,学生明确金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
10.将物质的量浓度之比为1:2的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)=3Z(g)+Q(s)△H>O,下列叙述一定正确的是( )
| A. | 当容器中X与Y的物质的量浓度之比满足1:2时,反应达到平衡 | |
| B. | 达到平衡后,反应速率3v正(Y)=2v逆(z) | |
| C. | 达到平衡时,X的转化率为25%,则平衡常数K值为$\frac{1}{16}$ | |
| D. | 达到平衡后,升高温度,X的体积分数增大 |
14.下列事实,不能用勒夏特列原理解释的是( )
| A. | 溴水中有平衡:Br2+H2O=HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红 | |
| C. | 对CO+NO2=CO2+NO,平衡体系增大压强可使颜色变深 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
11.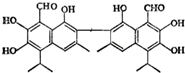 中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )
中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )
 中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )
中央电视台曾报道纪联华超市在售的某品牌鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋.专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致.其结构简式如图所示:下列说法不正确的是( )| A. | 该化合物的分子式为:C30H30O8 | |
| B. | 1mol棉酚最多可与10mol H2加成,与6molNaOH反应 | |
| C. | 在一定条件下,可与乙酸反应生成酯类物质 | |
| D. | 该物质可以使酸性高锰酸钾溶液褪色 |
8.元素周期表中有相邻元素A、B、C,A与B同周期,B与C同主族,它们的原子最外层电子数之和为19,原子序数之和为33,则( )
| A. | B位于第二周期第ⅣA族 | |
| B. | A在同周期元素中原子半径最小 | |
| C. | A、B没有最高正化合价 | |
| D. | B、C所形成的化合物会引发温室效应 |
9.下列选项属于碳链异构的是( )
| A. | CH3CH2CH2CH3和CH3CH(CH3)2 | B. | CH2═C(CH3)2和CH3CH═CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2CH2COOH和CH3COOCH2CH3 |
 利用如图装置可验证酸的强弱规律.
利用如图装置可验证酸的强弱规律. .
.
 .
.