题目内容
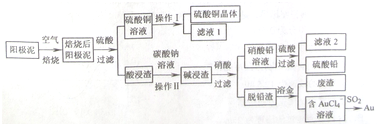
14.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略).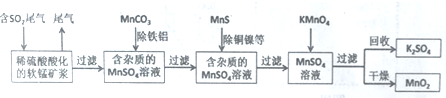
请回答下列问题;
(1)上述流程中多次涉及到过滤操作,实验进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗;其中玻璃棒的作用是引流,防止液体溅出.
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是6.0×10-26mol/L.
(4)工业采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式MnO42--e-=MnO4-.
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是bc(填编号)
a.NaOH溶液、酚酞试液
b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液
d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过bca制得硫酸锰晶体.(MnSO4•H2O,相对分子质量为169)
a.过滤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(7)已知废气中SO2浓度为8.4g/m3,软锰矿浆对SO2的吸收率可以达90%,则处理1000m3烧煤尾气,可得硫酸锰晶体质量为20.0kg(结果保留3位有效数字)
分析 二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰.
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗,玻璃棒起引流作用,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,从而促进Al3+和Fe3+水解;
(3)根据c(S2-)=$\frac{Ksp(NiS)}{c(N{i}^{2+})}$计算溶液中c(S2-),再根据Ksp(CuS)=c(Cu2+)×c(S2-)计算计算溶液中Cu2+的浓度;
(4)隋性电极作阳极,铁作阴极,阳极上发生氧化反应,阳极上是MnO42-失去电子生成MnO4-;
(5)进行定量测定尾气中二氧化硫的含量,由于吸收二氧化硫的试剂,与二氧化硫反应现象明显,便于反应终点的判断;
(6)由溶液得到晶体,应采取蒸发浓缩、冷却结晶,过滤得到晶体;
(7)结合硫原子守恒可知,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,进而计算硫酸锰晶体质量.
解答 解:二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰.
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗,玻璃棒起引流作用,防止液体溅出;
故答案为:烧杯、漏斗;引流,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{1.4×1{0}^{-24}}{1×1{0}^{-5}}$mol/L=1.4×10-19mol/L,
由Ksp(CuS)=c(Cu2+)×c(S2-),可知溶液中Cu2+的浓度为$\frac{8.4×1{0}^{-45}}{1.4×1{0}^{-19}}$mol/L=6.0×10-26mol/L,
故答案为:6.0×10-26;
(4)隋性电极作阳极,铁作阴极,阳极上发生氧化反应,阳极上是MnO42-失去电子生成MnO4-,阳极的电极反应式为:MnO42--e-=MnO4-,
故答案为:MnO42--e-=MnO4-;
(5)a.用NaOH溶液、酚酞试液吸收二氧化硫,反应生成亚硫酸钠,亚硫酸钠溶液呈碱性,溶液颜色变化不明显,故a错误;
b.用稀H2SO4酸化的KMnO4溶液吸收二氧化硫,溶液有紫色变为无色,反应完全,可准确测定气体的含量,故b正确;
c.用碘水、淀粉溶液吸收二氧化硫,溶液有蓝色变为无色,反应完全,可准确测定气体的含量,故c正确;
d.氨水本身易挥发,不宜进行定量测定,且终点判断误差较大,故d错误,
故选:bc;
(6)除杂后得到的MnSO4溶液可以通过蒸发浓缩、冷却结晶、过滤得硫酸锰晶体,
故选:bca;
(7)由硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,则硫酸锰晶体的质量为$\frac{1000{m}^{3}×8.4g/{m}^{3}×90%}{64g/mol}$×169g/mol≈2×104g=20.0kg,
故答案为:20.0.
点评 本题以化学工业流程为载体,考查混合物分离提纯的综合应用、溶度积有关计算、电极反应式、实验方案评价、化学计算等,是对学生综合能力的考查,综合性较强,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
 2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.(1)【知识回访】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)CuHgAg Pt Au.请你在横线上填写对应金属的元素符号.
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu>Cr; 猜想3.你的猜想是Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
(3)【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 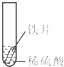 | 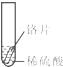 | 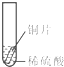 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡,溶液不变色 |
小聪得到的结论是:猜想1正确.
(5)【知识运用】
将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.若能进行,请你写出反应的化学方程式Cr+FeSO4=CrSO4+Fe.
| A. | 氨基酸、多肽、蛋白质都具有两性 | |
| B. | 利用油脂在酸性条件下水解,可以产生甘油和肥皂 | |
| C. | 淀粉与纤维素分子式都为(C6H10O5)n,但结构不同,所以它们互为同分异构体 | |
| D. | 饱和Na2SO4、CuSO4溶液均可用于蛋白质的盐析 |
 .
.
 .
.