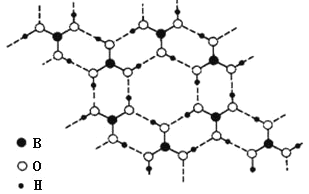
题目内容
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。
【答案】![]() 共价 HCl NaOH
共价 HCl NaOH
【解析】
由元素周期表的结构可知,A为H元素,B为Na元素,C为C元素,D为N元素,E为S元素,F为Cl元素。
(1)D为N元素,其原子结构示意图为:![]() ;
;
(2)A为H元素,F为Cl元素,两者形成的化合物为HCl,HCl中只含有共价键;
(3)E为S元素,F为Cl元素,Cl的非金属性更强,所以HCl更稳定;
(4)B为Na元素,其最高价氧化物的水化物的化学式为NaOH。

 高中必刷题系列答案
高中必刷题系列答案【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。