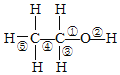题目内容
【题目】氮、硫的化合物合成、应用以及对环境的影响一直是科学界研究的热点。
(1)尿素主要以NH3和CO2为原料进行合成。主要通过以下两个反应进行:
反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
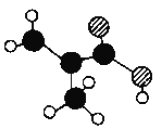
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
请回答:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
2NH3(l)+CO2(g) ΔH3=_____________,该反应能自发进行的主要原因是__________________.
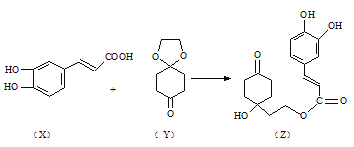
(2)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
S2(g)+2CO2(g),在恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。
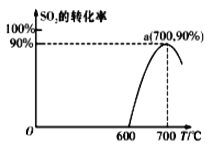
①若700℃发生该反应,经3分钟达到平衡,计算0—3分钟v(S2)=_______molL-1min-1,该温度下的平衡常数为_________.
②若该反应在起始温度为700℃的恒容绝热容器中进行,达到平衡时SO2的转化率________90%(填“>”、“<”或“=”).
③下列说法一定能说明该反应达到平衡状态的是_______.
A.焦炭的质量不再变化时
B.CO2、SO2的浓度相等时
C.SO2的消耗速率与CO2的生成速率之比为1:1
D.容器的总压强不再变化时
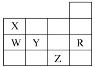
(3) NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示.

石墨I附近发生的反应为__________________________________,当外电路通过1mole-,正极上共消耗_______mol N2O5 。
【答案】+95.5 kJ·mol-1 ΔS>0 0.15 36.45 < AD NO2+NO3--e-=N2O5 0.5
【解析】
(1)根据盖斯定律(反应1+反应2)×(-1)得到;反应自发进行的条件是△H-T△S<0;
(2)①利用反应的三段式结合反应速率公式、平衡常数表达式计算;
②700℃时升高温度,SO2的转化率降低,则平衡逆向移动,正向反应为放热反应,该体系相当在恒温恒容平衡体系中升温,平衡逆向移动;
③化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(3)石墨I为电池的负极:NO2失电子生成N2O5,写出电极反应式;写出反应的总方程式再计算电子转移数。
(1)反应1:2NH3(l)+CO2(g)![]() H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
H2NCOONH4(l) ΔH1= -117.2 kJ·mol-1
反应2:H2NCOONH4(l)![]() H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
H2O(l)+CO(NH2)2(l) ΔH2=+21.7 kJ·mol-1
根据盖斯定律(反应1+反应2)×(-1)得到:CO(NH2)2 (l)+H2O(l)![]() 2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
2NH3(l)+CO2(g) ΔH3=[-117.2 kJ·mol-1+(+21.7 kJ·mol-1)]×(-1)=+95.5 kJ·mol-1 ,该反应能自发进行的主要原因是:该反应是吸热反应,反应能发生则△S>0;
(2)① 反应的三段式为 2C(s)+2SO2(g)![]() S2(g)+2CO2(g)
S2(g)+2CO2(g)
起始浓度(mol·L-1) 1 0 0
变化浓度(mol·L-1) 0.9 0.45 0.9
平衡浓度(mol·L-1) 0.1 0.45 0.9
v(S2)=△c÷△t=0.45mol·L-1÷3min=0.15mol/(L·min)
该温度下的平衡常数k=![]() =
=![]() =36.45;
=36.45;
②1 mol·L-1SO2与足量的焦炭在恒容、700℃反应时,SO2的转化率为90%,若1 mol·L-1SO2与足量的焦炭在恒容、绝热容器中反应,由于反应放热,容器内温度升高,所以恒容、绝热容器中的反应相当在恒容、700℃反应平衡的基础上升温,则平衡逆向进行,SO2的转化率降低;
③A.焦炭的质量减少,则反应正向进行,焦炭的质量增加,则反应逆向进行,若焦炭的质量不再变化时,则反应达到平衡状态,故A正确;
B.CO2、SO2的浓度相等时,不能确定正逆反应速率是否相等,所以不能确定反应是否达到平衡状态,故B错误;
C.无论反应是否达到平衡,SO2的消耗速率与CO2的生成速率始终相等,所以SO2的消耗速率与CO2的生成速率之比为1:1时,不能确定反应状态是否平衡,故C错误;
D.反应正向是气体体积增大的反应,反应正向进行,容器压强增大,逆向进行,容器压强减小,所以容器的总压强不再变化时,反应达到平衡状态,故D正确;
故选AD;
(3)石墨I,NO2失电子生成N2O5,附近发生的反应为NO2+NO3--e-=N2O5;
总反应为:4NO2+O2=2N2O5,每转移4mol电子,生成2molN2O5,当外电路通过1mole-,正极上共消耗 0.5mol N2O5 。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案