题目内容
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
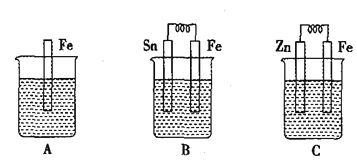
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
【答案】1s22s22p63s23p63d5 N2 配位键 1 sp N>O>C K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高 ![]()
【解析】
(1)Fe是26号元素,核外有26个电子,失去3个电子得到Fe3+,根据构造原理写出基态Fe3+的核外电子排布式;
(2) CN-有2个原子,价层电子数为10;K4[Fe(CN)6]是离子化合物,其中![]() 含有共价键和配位键,1个
含有共价键和配位键,1个![]() 中含有6个配位键,CN-中含有C≡N,1个C≡N中含有1个σ键、2个π键,即1个
中含有6个配位键,CN-中含有C≡N,1个C≡N中含有1个σ键、2个π键,即1个![]() 中含有12个σ键,据此计算解答;
中含有12个σ键,据此计算解答;
(3)CN中中心原子C的价层电子对数为2,即CN-的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素;同一周期元素电负性随着原子序数增大而增大;
(4)①金属的金属键越强,熔点越高;
②设晶胞的边长为x,则![]() ,该晶胞中Fe原子数为:8×1/8+1=2,
,该晶胞中Fe原子数为:8×1/8+1=2,![]() ,晶胞密度为:
,晶胞密度为:![]() 计算密度。
计算密度。
(1)Fe原子核外有26个电子,失去3个电子得到Fe3+,基态Fe3+的核外电子排布式:1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(2)CN-有2个原子,价层电子数为10,则与CN-互为等电子体的分子为N2;K4[Fe(CN)6]是离子化合物,存在离子键,其中![]() 含有共价键和配位键,即化学键为离子键、配位键和共价键;1个
含有共价键和配位键,即化学键为离子键、配位键和共价键;1个![]() 中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个σ键、2个π键,即1个
中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个σ键、2个π键,即1个![]() 中含有12个σ键,所以含有12mol σ键的K4[Fe(CN)6]的物质的量为1mol,故答案为:N2;配位键;1;
中含有12个σ键,所以含有12mol σ键的K4[Fe(CN)6]的物质的量为1mol,故答案为:N2;配位键;1;
(3)CN中中心原子C的价层电子对数为2,即CN的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C.N、O第一电离能大小顺序为N>O>C;故答案为:sp;N>O>C;
(4)①K和Na都为金属晶体,K和Na价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高,故答案为:K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高;
②设晶胞的边长为x,则![]() ,晶胞体积
,晶胞体积![]() ,该晶胞中Fe原子数为:8×1/8+1=2,
,该晶胞中Fe原子数为:8×1/8+1=2,![]() ,晶胞密度为:
,晶胞密度为: ,故答案为:
,故答案为:![]() 。
。

【题目】辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________。
(2)调节pH的目的是___________,pH的调节范围为___________。
(3)生成MnCO3沉淀的离子方程式为___________。
(4)操作A为___________。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________mol无水Cu(NO3)2。(计算结果精确到小数点后1位)