题目内容
【题目】(1) A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
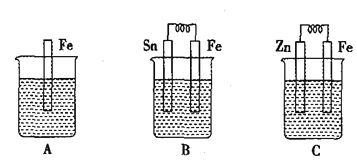
①B中Sn极的电极反应式为__________,Sn极附近溶液的pH_____(填“增大”、“减小”或“不变”)。
②C中总反应离子方程式为_____________,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是______(填“a”或“b”)电极,该极的电极反应是_______。
②电池工作一段时间后电解质溶液的pH____(填“增大”、“减小”或“不变”)。
【答案】 2H++2e-=H2↑ 增大 2H++Zn = H2↑+Zn2+ B>A>C a CH4 - 8e- + 10 OH- = CO32- + 7H2O 减小
【解析】试题分析:(1) A中没有形成原电池,为铁的化学腐蚀; B中构成原电池,Sn极是正极、铁极是负极; C中构成原电池,锌是负极、铁是正极;
(2)甲烷燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极,总反应是CH4+2O2+2KOH=K2CO3+3H2O。
解析:根据以上分析,(1)①B中Sn是正极,发生还原反应,电极反应式为2H++2e-=H2↑,Sn极附近溶液氢离子得电子生成氢气,氢离子浓度减小, pH增大。
②C中构成原电池,锌是负极、铁是正极,总反应离子方程式为2H++Zn = H2↑+Zn2+,原电池负极腐蚀速率>化学腐蚀速率>原电池正极腐蚀速率, A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C;
(2)甲烷燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极,总反应是CH4+2O2+2KOH=K2CO3+3H2O。①电池的负极是a电极,该极失电子发生氧化反应,电极反应是CH4 - 8e- + 10 OH- = CO32- + 7H2O。
②根据总反应式,反应消耗氢氧化钾,电池工作一段时间后电解质溶液的pH减小。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在 KClO3 晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
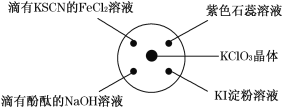
选项 | 实验现象 | 结论 |
A | 滴有 KSCN 的 FeCl2 溶液变红色 | Cl2 具有还原性 |
B | 滴有酚酞的 NaOH 溶液褪色 | Cl2 具有酸性 |
C | 淀粉 KI 溶液中变蓝色 | Cl2 具有氧化性 |
D | 石蕊溶液先变为红色后褪色 | Cl2 具有漂白性 |
A. A B. B C. C D. D