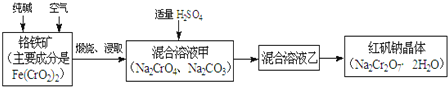
ћвƒњƒЏ»Ё
°Њћвƒњ°њї‘Ќ≠њу «“ї÷÷÷Ў“™µƒЌ≠њу ѓ£ђ÷ч“™Їђ”–Ѕтїѓ—«Ќ≠£®Cu2S£©£ђїє”–Fe2O3°ҐSiO2Љ∞“ї–©≤ї»№–‘‘”÷ °£“ї÷÷“‘ї‘Ќ≠њу ѓќ™‘≠Ѕѕ÷∆±ЄѕхЋбЌ≠ЊІћеµƒє§“’Ѕч≥ћ»зѕ¬£Ї

“—÷™£Ї≤њЈ÷љр ф—фјл„”…ъ≥…«в—хїѓќп≥ЅµнµƒpHЈґќІ»зѕ¬±нЋщ Њ£®њ™ Љ≥ЅµнµƒpH∞іљр фјл„”≈®ґ»ќ™1.0mol/LЉ∆Ћг£©
јл„” | њ™ Љ≥ЅµнµƒpH | Ќк»Ђ≥ЅµнµƒpH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
їЎірѕ¬Ѕ–ќ ћв
£®1£©љю»°Їуµ√µљµƒљю≥ц“Ї÷–Їђ”–CuSO4°ҐMnSO4°£–і≥цљю»° ±≤ъ…ъCuSO4°ҐMnSO4Јі”¶µƒїѓ—ІЈљ≥ћ љ__________°£
£®2£©µчљЏpHµƒƒњµƒ «___________£ђpHµƒµчљЏЈґќІќ™___________°£
£®3£©…ъ≥…MnCO3≥Ѕµнµƒјл„”Јљ≥ћ љќ™___________°£
£®4£©≤ў„чAќ™___________°£
£®5£©”…ї‘Ќ≠њу÷∆»°Ќ≠µƒЈі”¶єэ≥ћњ…“‘±н Њќ™£Ї
2Cu2S£®s£©+3O2£®g£©®T 2Cu2O£®s£©+ 2SO2£®g£©°чH=©Б768.2kJ/mol
2Cu2O£®s£©+ Cu2S£®s£©®T 6Cu£®s£©+ SO2£®g£©°чH=" +116.0" kJ/mol
‘т”…Cu2S”лO2Љ”»»Јі”¶…ъ≥…Cuµƒ»»їѓ—ІЈљ≥ћ љќ™___________°£
£®6£©»ф”√Їђ85% Cu2S£®Mr=160£©µƒї‘Ќ≠њујі÷∆±ЄќёЋЃCu£®NO3£©2£ђЉў…иљю»°¬ ќ™95%£ђµчљЏpH ±ЋрCu 3%£ђ’ф∞±єэ≥ћ÷–”–5%ќі„™їѓќ™CuO£ђ∆дЋьєэ≥ћ÷–ќёЋрЇƒ£ђ‘т1.6 kg’в—щµƒї‘Ќ≠њу„оґаƒ№÷∆±Є__________molќёЋЃCu£®NO3£©2°£(Љ∆ЋгљбєыЊЂ»Јµљ–° эµгЇу1ќї)
°Њір∞Є°њ2MnO2 + Cu2S + 4H2SO4 £љS°э+ 2CuSO4 + 2MnSO4 +4H2O ћъјл„”„™їѓ≥…«в—хїѓћъЌк»Ђ≥Ѕµн 3.2°№pH£Љ4.4 Mn2+ + NH3 + HCO3©Б£љMnCO3°э + NH4+ ’фЈҐ≈®Ћх°Ґјд»іљбЊІ£®єэ¬Ћ£© Cu2S£®s£©+ O2£®g£©£љ2Cu£®s£©+ SO2£®g£©°чH£љ©Б217.4 kJ/mol 14.9
°Њљвќц°њ
£®1£©ЄщЊЁє§“’Ѕч≥ћљю»° ±µƒЈі”¶£ЇCu2S £Ђ MnO2 £Ђ H2SO4 °ъ MnSO4 £Ђ CuSO4 £Ђ H2O + S£ђЄщЊЁїѓЇѕЉџµƒ…эљµ≈д∆љ£ђCu2S’ыће…эЄя4£ђMnO2ѕ¬љµ2£ђ„о–°єЂ±ґ э4£ђMnO2ЇЌMnSO4µƒѕµ эќ™2£ђCu2Sµƒѕµ эќ™1£ђЄщЊЁ‘≠„”Єц э ЎЇг£ђ≈д∆љ∆дЋы£ђCu2S£Ђ2MnO2£Ђ4H2SO4£љ2CuSO4£Ђ2MnSO4£Ђ2S°э£Ђ4H2O£ї
£®2£©µчљЏpHµƒƒњµƒ»√ћъ‘™ЋЎ„™їѓ≥…Fe(OH)3£ђ≥э»•£ђЄщЊЁ µ—йƒњµƒЇЌpHЈґќІ£ђFe(OH)3»Ђ≤њ„™їѓ≥…≥Ѕµн£ђµЂ≤їƒ№…ъ≥…Cu(OH)2£ђ“тіЋpHµƒЈґќІ”¶ «3.2°№pH£Љ4.4£ї
£®3£©ЄщЊЁЅч≥ћЌЉMn2£Ђ£ЂHCO3£≠£ЂNH3°ъMnCO3°э£ЂNH4£Ђ£ђїѓЇѕЉџќё±дїѓ£ђ≈д∆љµ√£ЇMn2£Ђ£ЂHCO3£≠£ЂNH3£љMnCO3°э£ЂNH4£Ђ£ї
£®4£©CuO£Ђ2HNO3£љCu(NO3)2£ЂH2Oі”»№“Ї÷–µ√µљЊІће£ђ≤…”√’фЈҐ≈®Ћх°Ґјд»іљбЊІ£ї
£®5£©Ѕљ љѕаЉ”£Ї3Cu2S(s)£Ђ3O2(g)£љ6Cu(s)£Ђ3SO2°чH£љ(£≠768.2£Ђ116.0)kJ°§mol£≠1£љ£≠652.2kJ°§mol£≠1£ђЉіCu2S(s)£ЂO2(g)£љ2Cu(s)£ЂSO2(g) °чH£љ£≠217.4kJ°§mol£≠1£ї
£®6£©ЄщЊЁЌ≠‘≠„” ЎЇгњ…÷™n[Cu(NO3)2]£љ![]() £љ14.9mol°£
£љ14.9mol°£

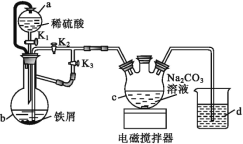
°Њћвƒњ°њ µ—й “≥£јы”√Љ„»©Ј®≤вґ®(NH4)2SO4—щ∆Ј÷–µ™µƒ÷ ЅњЈ÷ э£ђ∆дЈі”¶‘≠јнќ™£Ї4NH![]() £Ђ6HCHO=3H£Ђ£Ђ6H2O£Ђ(CH2)6N4H£Ђ[µќґ® ±£ђ1 mol (CH2)6N4H£Ђ”л1 mol H£Ђѕаµ±]£ђ»їЇу”√NaOH±к„Љ»№“Їµќґ®Јі”¶…ъ≥…µƒЋб°£ƒ≥–Ћ»§–°„й”√Љ„»©Ј®љш––ЅЋ»зѕ¬ µ—й£Ї
£Ђ6HCHO=3H£Ђ£Ђ6H2O£Ђ(CH2)6N4H£Ђ[µќґ® ±£ђ1 mol (CH2)6N4H£Ђ”л1 mol H£Ђѕаµ±]£ђ»їЇу”√NaOH±к„Љ»№“Їµќґ®Јі”¶…ъ≥…µƒЋб°£ƒ≥–Ћ»§–°„й”√Љ„»©Ј®љш––ЅЋ»зѕ¬ µ—й£Ї
≤љ÷иҐс°°≥∆»°—щ∆Ј1.5 g£ї
≤љ÷иҐт°°љЂ—щ∆Ј»№љвЇу£ђЌк»Ђ„™“∆µљ250 mL»ЁЅњ∆њ÷–£ђґ®»Ё£ђ≥дЈ÷“°‘»£ї
≤љ÷иҐу°°“∆»°25.00 mL—щ∆Ј»№“Ї”Џ250 mL„ґ–ќ∆њ÷–£ђЉ”»л10 mL 20%µƒ÷––‘Љ„»©»№“Ї£ђ“°‘»°ҐЊ≤÷√5 minЇу£ђЉ”»л1°Ђ2µќЈ”ћ™»№“Ї£ђ”√NaOH±к„Љ»№“Їµќґ®÷Ѕ÷’µг°£∞і…ѕ ц≤ў„чЈљЈ®‘ў÷ЎЄі2іќ°£
(1)ЄщЊЁ≤љ÷иҐућоњ’£Ї
ҐўNaOH±к„Љ»№“Ї ҐЈ≈‘Џ____µќґ®є№÷–£ђ»фµќґ®є№”√’фЅуЋЃѕіµ”Їу£ђ÷±љ”Љ”»лNaOH±к„Љ»№“Їљш––µќґ®£ђ‘т≤вµ√—щ∆Ј÷–µ™‘™ЋЎµƒ÷ ЅњЈ÷ э________(ћо°∞∆Ђіу°±°∞∆Ђ–°°±їт°∞ќё”∞ѕм°±)°£
ҐЏµќґ®іпµљ÷’µг ±£ђЈ”ћ™÷Є ЊЉЅ”…________…Ђ±д≥…________…Ђ°£
Ґџѕ¬Ѕ–”–єЎ µ—й≤ў„чµƒЋµЈ®’э»Јµƒ «__________(ЋЂ—°)°£
A£Ѓ„ґ–ќ∆њ”√’фЅуЋЃѕіµ”Їу£ђЋЃќіµєЊ°£ђ‘тµќґ® ±”√»•NaOH±к„Љ»№“Їµƒћеїэ≤ї±д
B£Ѓµќґ®÷’µг ±£ђЄ© ”ґЅ э£ђ є≤вґ®љбєы∆Ђ–°
C£Ѓ÷їƒ№—°”√Ј”ћ™„ч÷Є ЊЉЅ
D£Ѓµќ»л„оЇу“їµќNaOH»№“Ї£ђ»№“ЇЌї»ї±д…Ђ£ђЉіќ™µќґ®÷’µг
E£Ѓµќґ® ±£ђ„у ÷њЎ÷∆µќґ®є№їо»ы£ђ”“ ÷ќ’≥÷„ґ–ќ∆њ£ђ±яµќ±я’сµі£ђ—џЊ¶„Ґ ”µќґ®є№÷–µƒ“Ї√ж
(2)µќґ®љбєы»зѕ¬±нЋщ Њ£Ї
µќґ®іќ э | іэ≤в»№“Їµƒћеїэ/mL | ±к„Љ»№“Їµƒћеїэ/mL | |
µќґ®«∞њћґ» | µќґ®Їуњћґ» | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
‘тЋщ”√»•µƒNaOH±к„Љ»№“Їµƒ∆љЊщћеїэќ™_______ mL£ђ»фNaOH±к„Љ»№“Їµƒ≈®ґ»ќ™0.100 0 mol°§L£≠1£ђ‘тЄ√—щ∆Ј÷–µ™‘™ЋЎµƒ÷ ЅњЈ÷ эќ™___________°£(Ѕ–≥цЉ∆Ћг љ≤ҐЉ∆Ћгљбєы)