题目内容
9.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族,称为类铅元素.下面关于它的原子结构和性质预测正确的是( )| A. | 类铅元素原子的最外层电子数为6 | B. | 其常见价态为+2、+3、+4 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小? |
分析 原子序数为114的元素属于第七周期第ⅣA族,称为类铅元素,利用第ⅣA族元素的性质的相似性和递变性来解答.
解答 解:A.位于第ⅣA族,族序数等于最外层电子数,则类铅元素原子的最外层电子数为4,故A错误;
B.位于第ⅣA族,常见的价态为+2、+4,故B错误;
C.同主族从上到下金属性在增强,则它的金属性比铅强,故C正确;
D.同主族从上到下原子半径在增大,则它的原子半径比铅大,故D错误;
故选C.
点评 本题考查元素的位置及性质,熟悉第ⅣA族元素的性质是解答本题的关键,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
19.下列说法正确的是( )
| A. | 所有的化学反应都有能量变化 | |
| B. | 需要加热的反应一定是吸热反应 | |
| C. | 所有的放热反应都可以在常温常压下自发进行 | |
| D. | 核能作为一种反应热,是理想的新能源 |
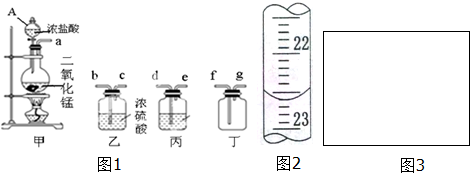
20.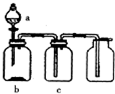 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
 使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )
使用下表提供的试剂,利用如图所示的装置,能达到实验目的是( )| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 |
| A | 稀盐酸 | 铁粉 | H2O | 制备并收集H2 |
| B | 稀硫酸 | Na2SO3粉末 | 浓硫酸 | 制备并收集干燥的SO2 |
| C | 浓盐酸 | KmnO4粉末 | NaOH溶液 | 制备并收集Cl2 |
| D | 浓氨水 | 生石灰 | 碱石灰 | 制备并收集干燥的NH3 |
| A. | A | B. | B | C. | C | D. | D |
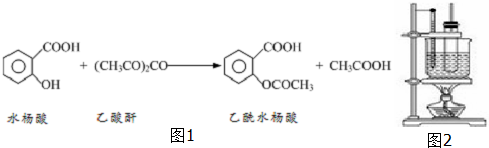
17.工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸).
【反应原理】
如图1
【物质性质】
【实验流程】
(1)物质制备:向大试管中依次加入2g水杨酸、5mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10min.装置如图2:
(2)产品结晶:取下大试管,置于冷水中冷却10min.待晶体完全析出,…抽滤,再洗涤晶体,抽干.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸1.8g.
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色.
【问题讨论】
(1)写出水杨酸与碳酸氢钠溶液反应的化学反应方程式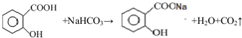 .
.
(2)写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式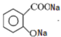 .
.
(3)流程(1)装置图中长导管的作用冷凝回流和平衡压强.
(4)控制反应温度85℃~90℃的原因既保持有较高的反应速率又减少物质的挥发.
(5)流程(2)中证明晶体洗涤干净的操作方法:取最后一次洗涤滤液少许于试管中,滴加少量氯化钡,再滴加稀盐酸,若无沉淀出现则洗涤干净,反之则未洗涤干净
(6)流程(4)中溶液显紫色,可能的原因是产品中仍然可能有水杨酸.
(7)1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗3mol NaOH.
(8)实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
【反应原理】
如图1

【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
(1)物质制备:向大试管中依次加入2g水杨酸、5mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10min.装置如图2:
(2)产品结晶:取下大试管,置于冷水中冷却10min.待晶体完全析出,…抽滤,再洗涤晶体,抽干.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸1.8g.
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色.
【问题讨论】
(1)写出水杨酸与碳酸氢钠溶液反应的化学反应方程式
 .
.(2)写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式
 .
.(3)流程(1)装置图中长导管的作用冷凝回流和平衡压强.
(4)控制反应温度85℃~90℃的原因既保持有较高的反应速率又减少物质的挥发.
(5)流程(2)中证明晶体洗涤干净的操作方法:取最后一次洗涤滤液少许于试管中,滴加少量氯化钡,再滴加稀盐酸,若无沉淀出现则洗涤干净,反之则未洗涤干净
(6)流程(4)中溶液显紫色,可能的原因是产品中仍然可能有水杨酸.
(7)1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗3mol NaOH.
(8)实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
14.下列哪种物质所含原子数与0.2molH3PO4所含原子数相等( )
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
 ,H的化学式为KHCO3;
,H的化学式为KHCO3;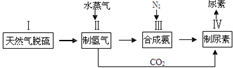
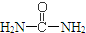 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.