题目内容
1.求1.7g NH3所含原子数?在标准状况下,NH3占有的体积为多少?分析 根据n=$\frac{m}{M}$计算氨气物质的量,原子物质的量为氨气的4倍,根据N=nNA计算所含原子数目;根据V=nVm计算氨气的体积.
解答 解:1.7g NH3的物质的量为$\frac{1.7g}{17g/mol}$=0.1mol,原子物质的量为氨气的4倍,所含原子数目为0.1mol×4×6.02×1023mol-1=2.408×1023,标况下氨气体积为0.1mol×22.4L/mol=2.24L,
答:1.7g NH3所含原子数目为2.408×1023,标况下氨气体积为2.24L.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.观察下列四组物质,回答相关问题.
A CaO Na2O CuO CO2 B H2 N2 Cl2 Cu
C HCl HNO3 H2O H2SO4 D O2 NH3 NaCl KNO3
(1)将上面的物质按表1的要求分类,填写表中的空白.
表1
(2)表1中的四种物质在自然环境中形成Cu2(OH)2CO3--碱式碳酸铜,也叫铜绿.写出形成碱式碳酸铜的化学方程式.CO2+2Cu+O2+H2O=Cu2(OH)2CO3
(3)某铜器被锈蚀,表面形成一层铜绿.保护铜器,清除铜绿,应该选择A;
A.稀HCl B.HNO3 C.浓H2SO4
根据选择的物质,写出该物质与铜绿反应的离子方程式:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
A CaO Na2O CuO CO2 B H2 N2 Cl2 Cu
C HCl HNO3 H2O H2SO4 D O2 NH3 NaCl KNO3
(1)将上面的物质按表1的要求分类,填写表中的空白.
表1
| 组别 | A | B | C | D |
| 分类标准 | 金属氧化物 | 强酸 | ||
| 不符合分类标准的物质 | Cu | O2 |
(3)某铜器被锈蚀,表面形成一层铜绿.保护铜器,清除铜绿,应该选择A;
A.稀HCl B.HNO3 C.浓H2SO4
根据选择的物质,写出该物质与铜绿反应的离子方程式:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
12.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl在土壤中反应生成氨气会降低肥效 |
| D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
9.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族,称为类铅元素.下面关于它的原子结构和性质预测正确的是( )
| A. | 类铅元素原子的最外层电子数为6 | B. | 其常见价态为+2、+3、+4 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小? |
16.下列电离方程式正确的是( )
| A. | BaSO4═Ba2++SO42- | |
| B. | Na2CO3═Na++CO32- | |
| C. | SO3溶于水溶液可以导电,故其属于电解质 | |
| D. | CaCO3投入水中,溶液不导电,说明CaCO3是非电解质 |
12.下列图示操作正确的是( )
| A. |  灼烧 | B. | 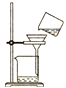 过滤 | C. |  分液 | D. |  蒸馏 |
9.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol 苯含有6 NA个C-H键 | |
| B. | 常温常压下,22.4 L H2O含有3NA个原子 | |
| C. | 1L 0.1 mol•L-1NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 23g Na与足量H2O反应完全共转移2NA个电子 |
8. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2 (用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”);
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1;
②下列措施中能使平衡时K增大的是A(填选项字母).
A.升高温度 B.增大压强C.再充入一定量的CO2 D.再加入一定量铁粉.
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1;
②下列措施中能使平衡时K增大的是A(填选项字母).
A.升高温度 B.增大压强C.再充入一定量的CO2 D.再加入一定量铁粉.