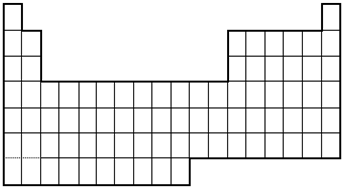
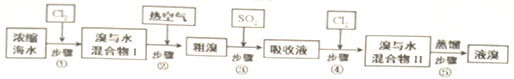
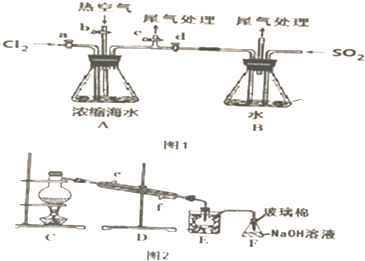
题目内容
19.下列说法正确的是( )| A. | 所有的化学反应都有能量变化 | |
| B. | 需要加热的反应一定是吸热反应 | |
| C. | 所有的放热反应都可以在常温常压下自发进行 | |
| D. | 核能作为一种反应热,是理想的新能源 |
分析 A.化学反应中一定伴随着能量变化;
B.需要加热才能进行的反应,不一定是吸热反应;
C.放热反应不一定在常温常压下自发进行;
D.核反应不是化学反应.
解答 解:A.化学反应中通常伴随有能量的变化,故A正确;
B.需要加热才能进行的反应,不一定是吸热反应,如铝热反应是放热反应,但需在加热条件下以保证足够的热量引发氧化铁和铝粉反应,故B错误;
C.放热反应不一定在常温常压下自发进行,如铝热反应,故C错误;
D.核反应不是化学反应,核能不是反应热,故D错误.
故选A.
点评 本题考查化学反应中的能量变化,为高频考点,侧重于基本理论的理解和应用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
6.下列分离混和物的实验计划中不正确的是( )
| A. | 分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃)--蒸馏 | |
| B. | 从含有少量NaCl的KNO3溶液中提取KNO3--热水溶解、降温结晶、过滤 | |
| C. | 从水中分离出碘的CCl4溶液--用分液漏斗分液 | |
| D. | 将溴水中的溴转移到有机溶剂中--加入酒精萃取 |
14.运用相关化学知识进行判断,下列结论错误的是( )
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 增大浓度或使用催化剂均能增大活化分子百分数,增大化学反应速率 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 铬的价电子电子排布式为3d54s1而不是3d44s2是因为半满稳定 |
4.在10克D2O中,含有的中子数是阿伏加德罗常数的( )
| A. | 1倍 | B. | 3倍 | C. | 5倍 | D. | 7倍 |
11.观察下列四组物质,回答相关问题.
A CaO Na2O CuO CO2 B H2 N2 Cl2 Cu
C HCl HNO3 H2O H2SO4 D O2 NH3 NaCl KNO3
(1)将上面的物质按表1的要求分类,填写表中的空白.
表1
(2)表1中的四种物质在自然环境中形成Cu2(OH)2CO3--碱式碳酸铜,也叫铜绿.写出形成碱式碳酸铜的化学方程式.CO2+2Cu+O2+H2O=Cu2(OH)2CO3
(3)某铜器被锈蚀,表面形成一层铜绿.保护铜器,清除铜绿,应该选择A;
A.稀HCl B.HNO3 C.浓H2SO4
根据选择的物质,写出该物质与铜绿反应的离子方程式:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
A CaO Na2O CuO CO2 B H2 N2 Cl2 Cu
C HCl HNO3 H2O H2SO4 D O2 NH3 NaCl KNO3
(1)将上面的物质按表1的要求分类,填写表中的空白.
表1
| 组别 | A | B | C | D |
| 分类标准 | 金属氧化物 | 强酸 | ||
| 不符合分类标准的物质 | Cu | O2 |
(3)某铜器被锈蚀,表面形成一层铜绿.保护铜器,清除铜绿,应该选择A;
A.稀HCl B.HNO3 C.浓H2SO4
根据选择的物质,写出该物质与铜绿反应的离子方程式:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
8.某化学小组对以下四种物质的水溶液加热蒸干并灼热,最终不能得到该物质固体的是( )
①氯化铁 ②碳酸钠 ③硫酸亚铁 ④硅酸钠.
①氯化铁 ②碳酸钠 ③硫酸亚铁 ④硅酸钠.
| A. | 仅①③ | B. | 仅②④ | C. | 仅①③④ | D. | 仅①②③ |
9.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族,称为类铅元素.下面关于它的原子结构和性质预测正确的是( )
| A. | 类铅元素原子的最外层电子数为6 | B. | 其常见价态为+2、+3、+4 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小? |