题目内容
【题目】甲酸(HCOOH)是一种可再生的储氢物质,其产生、储存和应用H2的循环示意图如下。

(1)HCOOH的结构式是________。
(2)产生H2:上图中光催化产生H2的化学方程式是________。
(3)储存H2:
Ⅰ.CO2加氢法:
①已知:2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH =-510 kJ·mol1
2H2 (g) + O2 (g) = 2H2O (l) ΔH =-572 kJ·mol1
则CO2 (g) + H2 (g) = HCOOH (l) ΔH =________。
此反应的化学平衡常数表达式:K=________。
②增大压强,CO2的平衡转化率升高,原因是________。
即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是________。
Ⅱ.电化学还原法:
在碳酸氢盐的水溶液中,CO2还原成甲酸的原理如图1所示。

![]()

![]()
③图1中,阴极的电极反应式是________。
④依据图1,在图2的方框中填出相应物质的化学式或离子符号_____。
【答案】 ![]() 2H2O ==== 2H2↑+ O2↑ -31 kJ·mol1
2H2O ==== 2H2↑+ O2↑ -31 kJ·mol1 ![]() 反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行 选择合适的催化剂,增大c(H2) CO2 + H2O +2e-=HCOO-+ OH-
反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行 选择合适的催化剂,增大c(H2) CO2 + H2O +2e-=HCOO-+ OH- 
【解析】(1)HCOOH的结构式是![]() ;(2)根据图中信息可知,水催化分解产生O2和H2的化学方程式是2H2O == 2H2↑+ O2↑;(3)①已知反应①2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH1 =-510 kJ·mol1,②2H2 (g) + O2 (g) = 2H2O (l) ΔH2 =-572 kJ·mol1
;(2)根据图中信息可知,水催化分解产生O2和H2的化学方程式是2H2O == 2H2↑+ O2↑;(3)①已知反应①2HCOOH (l) + O2 (g) = 2CO2 (g) + 2H2O (l) ΔH1 =-510 kJ·mol1,②2H2 (g) + O2 (g) = 2H2O (l) ΔH2 =-572 kJ·mol1
,根据盖斯定律,由![]() 得反应CO2 (g) + H2 (g) = HCOOH (l) ΔH =
得反应CO2 (g) + H2 (g) = HCOOH (l) ΔH =![]() ;反应CO2 (g) + H2 (g) = HCOOH (l)的化学平衡常数表达式:K=
;反应CO2 (g) + H2 (g) = HCOOH (l)的化学平衡常数表达式:K=![]() ;②反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行,CO2的平衡转化率升高;即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是选择合适的催化剂,增大c(H2);③图1中,阴极上二氧化碳得电子产生HCOO-,电极反应式是CO2 + H2O +2e-=HCOO-+ OH-;④依据图1,在图2中连接正极的阳极上氢氧根离子失电子产生氧气,碳酸氢根离子在左室阴极上得电子产生甲酸故通入的是碳酸氢盐,补充如下图:
;②反应CO2 + H2=HCOOH是气体总分子数减少的反应,增大压强利于反应进行,CO2的平衡转化率升高;即使在高压和高温条件下,CO2的平衡转化率也不高,为实现CO2加氢向甲酸的高效转化还可以采取的措施是选择合适的催化剂,增大c(H2);③图1中,阴极上二氧化碳得电子产生HCOO-,电极反应式是CO2 + H2O +2e-=HCOO-+ OH-;④依据图1,在图2中连接正极的阳极上氢氧根离子失电子产生氧气,碳酸氢根离子在左室阴极上得电子产生甲酸故通入的是碳酸氢盐,补充如下图: 。
。

【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
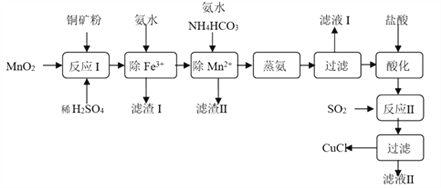
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2