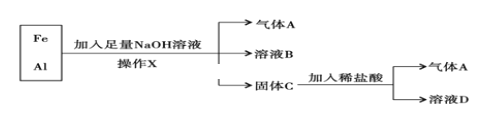
��Ŀ����
����Ŀ����Ԫ�������Ԫ�ؾ������������γɻ����������ܶࡣ
(1)����������Ԫ�صĵ�һ�����ܴӴ�С��˳��Ϊ__________����Ԫ�����Ԫ�����γ�OF2���ӣ��÷��ӵĿռ乹��Ϊ__________��
(2)���ݵȵ�����ԭ������NO�е�ԭ�ӹ���ӻ�������__________��1 mol O![]() �к��еĦм���ĿΪ__________����
�к��еĦм���ĿΪ__________����
(3)��Ԫ�غ���Ԫ�ؿ��γɶ��ּ�̬�Ľ�����������������Cr2O3��CrO3��CrO5�ȡ�Cr3����̬��������Ų�ʽΪ__________��
(4)�������ʵķ�����O3���ӵĽṹ�����Ƶ���__________��
A��H2O�� B��CO2������ C��SO2������ D��BeCl2
(5)O3�����Ƿ�Ϊ���Է��ӣ�__________��
���𰸡� F>N>O V�� sp 2NA 1s22s22p63s23p63d3 C ��
����������1���ɺ��ع����������֪����Ԫ�صĵ�һ�����ܴ�����Ԫ�أ�С�ڷ�Ԫ�أ��ɼ۲���ӶԻ������ۿ�֪��OF2����������ԭ�ӵļ۲���Ӷ�����4������2�Թ¶Ե��ӣ���ռ乹����V�Ρ���2�����ݵȵ�����ԭ����NO2����CO2��Ϊ�ȵ����壬���ߵĽṹ���ƣ�NO2���е�ԭ�ӵ��ӻ���ʽ��CO2��̼ԭ�ӵ��ӻ���ʽ��ͬ������sp�ӻ���O22����N2(������һ����������������)��Ϊ�ȵ����壬���1molO22������2NA����������3��Cr��ԭ��������24��Cr3����̬��������Ų�ʽΪ1s22s22p63s23p63d3����4��SO2��O3��Ϊ�ȵ����壬���ݼ۲���ӶԻ������۷�����SO2��O3���ӵĽṹ�����ƣ���ѡC����5��SO2��O3��Ϊ�ȵ����壬�ṹ���ƣ����������Ǽ��Է��ӣ�����Ҳ�Ǽ��Է��ӡ�

 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�����Ŀ������һ����Ҫ�İ뵼����ϡ���ҵ���þ��������Ҫ�ɷ�ΪGeS2�����ʲ���Ӧ����ȡGe���乤��������ͼ��ʾ��
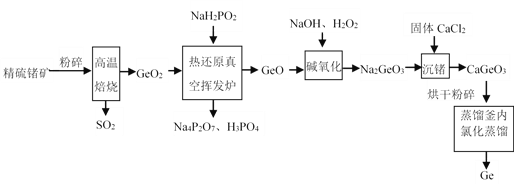
�ش��������⣺
��1����ʼ�������������Ŀ����______��
��2�����±��վ������Ļ�ѧ����ʽΪ______��
��3���Ȼ�ԭ��ջӷ�¯�ڷ�Ӧ�Ļ�ѧ����ʽΪ______��
��4���ڳ�������У����¶�Ϊ90�棬pHΪ14ʱ����������CaCl2/Ge�����ȣ��Գ����Ӱ�������ʾ��ѡ����Ѽ�����Ϊ______���10-15����15-20����20-25������������______��
��� | ��������CaCl2/Ge�� | ĸҺ��� ��mL�� | ���˺�Һ���ࣨmg/L�� | ���˺�Һ pH | ������ʣ�%�� |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
��5��ij�¶�ʱ������õ���CaGeO3��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵���������______��
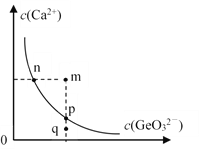
a��n����p���Ӧ��Ksp���
b��ͨ����������ʹ��Һ��q��䵽p��
c��q����CaGeO3��������
d������Na2GeO3����ʹ��Һ��n��䵽m��
��6��CaGeO3��ǿ�ᷴӦ�ɵõ�H2GeO3��0.l molL��1��NaHGeO3��ҺpH_____���������=��������7���ж�������______��ͨ������Ƚϣ�����25��ʱ��H2GeO3��Ka1=1.7��10��9��Ka2=1.9��10��13����