题目内容
【题目】合成氨的热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
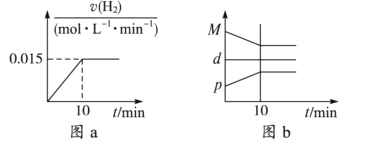
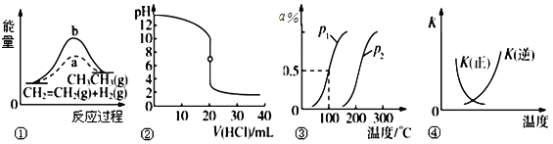
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
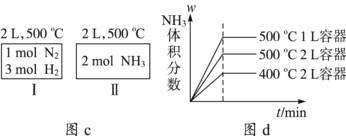
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
【答案】C
【解析】A、体系放出9.24kJ的热量,消耗氢气物质的量为9.24×3/92.4mol=0.3mol,根据化学反应速率的数学表达式,v(H2)=0.3/(2×10)mol/(L·min)=0.015mol/(L·min),氢气是反应物,其反应速率随着反应进行逐渐减小,故A错误;B、根据M=m/n,组分都是气体,在气体质量不变,向正反应方向进行,气体物质的量减小,则气体平均摩尔质量增大,根据密度的定义,气体质量不变,容器是恒容,气体体积不变,因此气体密度始终保持不变,根据反应方程式,向正反应方向进行,气体物质的量减小,压强减小,故B错误;C、这两个平衡为等效平衡,容器I中N2的转化率与容器II中NH3转化率之和为1,因此容器I放出热量与容器II吸收的热量之和为92.4kJ,故C正确;D、温度越高,化学反应速率越快,500℃1L容器,反应物浓度最大,因此首先达到平衡,其次是500℃2L容器,最后是400℃2L容器,故D错误。

 阅读快车系列答案
阅读快车系列答案