题目内容
【题目】CuCl为白色固体,微溶于水,不溶于乙醇和稀硫酸,在空气中迅速被氧化成绿色;见光则分解,变成褐色;已知CuCl+3Cl-=[CuCl4]3-。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
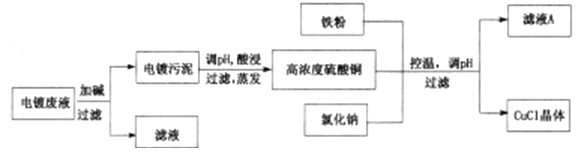
(1)图中的铁粉可以用二氧化硫气体代替,可以减少污染气体的排放,请写出用SO2代替铁粉进行反应的离子方程式:_____________。
(2)常温下形成电镀污泥时,溶液pH=9,已知Ksp[Fe(OH)3]=4×10-38,Ksp[Cu(OH)2]=2×10-20,此时溶液中c(Fe3+):c(Cu2+)=_______。
(3)析出CuCl晶体后,采用过滤的方法进行分离,再对晶体进行洗涤。下列关于洗涤的说法正确的是______(填序号)。
A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度
B.尽量少用水洗涤,防止其溶解或水解生成CuOH
C.可以用乙醇洗涤使产品快速干燥
D.洗涤时在漏斗中充分搅拌,使杂质尽可能地溶解达到除去的目的
E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液
(4)第三次过滤的滤液主要成分是_________。
(5)对污泥进行酸浸时的化学反应方程式为___________________。
(6)检验氧化亚铜晶体洗涤干净的操作是_______________。
(7)以粗铜为电极电解一定浓度的氯化钠溶液,控制一定的电压和电流,也可以制得氯化亚铜,写出电解时的阳极反应式:_____________。
【答案】 SO2+2C1-+2Cu2++2H2O=2CuC1↓+SO42-+4H+ 2×10-12 BCE Na2SO4和FeSO4 Cu(OH)2+H2SO4=CuSO4+2H2O 取最后一次洗涤液加入K3[Fe(CN)6],若无蓝色沉淀,则沉淀洗涤干净(或加入氯化钡溶液) Cu-e-+Cl-=CuCl↓
【解析】(1)SO2与硫酸铜及氯化钠溶液反应生成氯化亚铜、硫酸氢钠,反应的离子方程式为SO2+2C1-+2Cu2++2H2O=2CuC1↓+SO42-+4H+;(2)pH=9,c(OH-)=10-5mol/L, Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)=4×10-38,c(Fe3+)=4×10-23 mol/L,Ksp[Cu(OH)2]= c(Cu2+) c2(OH-)=2×10-20,c(Cu2+)=2×10-10 mol/L,此时溶液中c(Fe3+):c(Cu2+)=4×10-23 mol/L:2×10-10 mol/L =2×10-12;(3)A.因为存在CuCl的沉淀溶解平衡,所以用饱和NaCl溶液洗涤可以降低CuCl的溶解度,但会引入杂质氯化钠,选项A错误;B.尽量少用水洗涤,防止其溶解或水解生成CuOH,选项B正确;C.可以用乙醇洗涤使产品中水分带走快速干燥,选项C正确;D.洗涤时在漏斗中不能进行搅拌,应使水顺利流下,选项D错误;E.如果采用减压过滤,在洗涤时应该先打开阀门与空气相通,再关闭抽气泵,然后再向漏斗中加入洗涤液,选项E正确。答案选BCE;(4)铁粉与硫酸铜及氯化钠溶液反应生成氯化亚铜、硫酸亚铁和硫酸钠,第三次过滤的滤液主要成分是Na2SO4和FeSO4;(5)对污泥进行酸浸时是将氢氧化铜溶解生成硫酸钠,反应的化学反应方程式为Cu(OH)2+H2SO4=CuSO4+2H2O;(6)检验氧化亚铜晶体洗涤干净则不含硫酸亚铁,操作是取最后一次洗涤液加入K3[Fe(CN)6],若无蓝色沉淀,则沉淀洗涤干净或取最后一次洗涤液加入氯化钡溶液,若无白色沉淀,则沉淀洗涤干净;(7)电解时阳极铜失电子产生亚铜离子与氯离子反应生成氯化亚铜,电极反应式为:Cu-e-+Cl-=CuCl↓。