题目内容
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
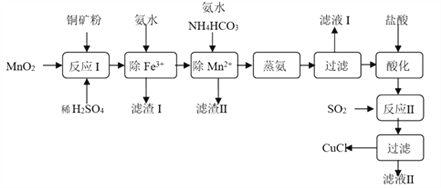
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S + MnO2 + H2SO4 → CuSO4 + S + MnSO4 + H2O(未配平);氧化产物为:__________。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为______________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3![]() [Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2+ +2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
【答案】 CuSO4 S Mn2+ + HCO3-+ NH3·H2O = MnCO3↓+ NH4+ + H2O c 减小压强,平衡逆向移动,利于蒸氨 SO2 +2Cu2+ + 2Cl- + 2H2O = 2 CuCl↓ + SO42- + 4H+ Cu-e-+ Cl- = CuCl↓ b c
【解析】分析:本题以初级铜矿粉为原料制备活性CuCl的流程为载体,考查流程的分析、氧化还原反应的分析、离子方程式的书写、外界条件对化学平衡的影响、电解原理、沉淀的转化。初级铜矿粉主要含Cu2S、CuS、Fe2O3、FeO等,铜矿粉中加入MnO2和稀硫酸,Cu2S、CuS与MnO2、稀硫酸反应生成CuSO4、S、MnSO4和H2O,Fe2O3与稀硫酸反应生成Fe2(SO4)3和H2O,FeO与MnO2、稀硫酸反应生成Fe2(SO4)3、MnSO4和H2O;反应I后加入氨水除去Fe3+;向除Fe3+后的溶液中加入氨水和NH4HCO3除去Mn2+,同时Cu2+转化成[Cu(NH3)4]2+;蒸氨时[Cu(NH3)4]2+先变成Cu(OH)2,Cu(OH)2受热分解成CuO,CuO用盐酸酸化得CuCl2溶液,SO2与CuCl2溶液反应制得CuCl,反应的化学方程式为2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl。电解制备CuCl时,阳极电极反应式为Cu-e-+Cl-=CuCl↓,阴极电极反应式为2H2O+2e-=H2↑+2OH-。
详解:(1)Cu2S参与反应的化学方程式为:Cu2S+MnO2+H2SO4→CuSO4+S+MnSO4+H2O,在该反应中,Mn元素的化合价由+4价降至+2价,MnSO4为还原产物;Cu元素的化合价由Cu2S中的+1价升至CuSO4中的+2价,S元素的化合价由Cu2S中的-2价升至单质S中的0价,氧化产物为CuSO4和S。
(2)除Mn2+时加入氨水和NH4HCO3得MnCO3沉淀,反应的离子方程式为Mn2++NH3·H2O+HCO3-=MnCO3↓+NH4++H2O。
(3)根据流程,蒸氨时[Cu(NH3)4]2+先变成Cu(OH)2,根据表中信息,c得到的残液颜色为无色透明,说明[Cu(NH3)4]2+转化率很大,蒸氨的条件应选c。选择该条件的原因是:减小压强,平衡Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-逆向移动,利于蒸氨。
[Cu(NH3)4]2++2OH-逆向移动,利于蒸氨。
(4)反应II为向CuCl2溶液中通入SO2制得CuCl,CuCl2被还原成CuCl,SO2被氧化成SO42-,反应的化学方程式为2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl,反应II的离子方程式为2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+。
(5)①在电解池中阳极发生失电子的氧化反应,根据装置图,阳极Cu失电子生成CuCl,生成CuCl的电极反应式为Cu-e-+Cl-=CuCl↓。
②靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀,淡黄色沉淀可能是CuOH,说明CuOH是黄色或淡黄色固体,不溶于水;电解时阴极电极反应式为2H2O+2e-=H2↑+2OH-,阴极区溶液呈碱性,Ksp(CuCl)=1.2![]() 10-6
10-6![]() Ksp(CuOH)=2
Ksp(CuOH)=2![]() 10-15,CuOH的溶解度小于CuCl,在阴极区CuCl转化为更难溶的CuOH;答案选bc。
10-15,CuOH的溶解度小于CuCl,在阴极区CuCl转化为更难溶的CuOH;答案选bc。





