题目内容
17.在一密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)+Q (Q>0)达到平衡.(1)升高温度,正反应速率增大(增大、减小、不变).平衡向逆方向移动.
(2)若容器容积为2L,开始加入的SO2为0.10mol,20s后测得SO3的物质的量为0.08mol,则O2的平均反应速率为0.001mol/(L•s)、
分析 (1)因为2SO2(g)+O2(g)?2SO3(g)+Q (Q>0)即放热反应,则升高温度,正反应速率增大,平衡向吸热方向移动;
(2)根据V=$\frac{△c}{△t}$进行计算.
解答 解:(1)因为2SO2(g)+O2(g)?2SO3(g)+Q (Q>0)即放热反应,则升高温度,正反应速率增大,平衡向吸热方向移动即逆方向移动,故答案为:增大;逆;
(2)由2SO2(g)+O2(g)?2SO3(g)反应,则20s后测得SO3的物质的量为0.08mol,则O2的变化量为0.04mol,所以O2的平均反应速率V=$\frac{△c}{△t}$=$\frac{\frac{0.04}{2}}{20}$=0.001mol/(L•s),故答案为:0.001.
点评 本题考查温度对化学平衡的影响以及反应速率的计算,注重了基础知识的考查,注意对基础知识的理解掌握,本题难度不大.

练习册系列答案
相关题目
7.已知 A、B、C、D、E 是短周期中原子序数依次增大的 5种主族元素,其中元素 A、E 的单质在常温下呈气态,元素 B 的原子最外层电子数是其电子层数的 2 倍,元素 C 在同周期的主族元素中原子半径最大,元素 D 的单质是金属,它与冷水反应缓慢,与沸水反应迅速.下列说法正确的是( )
| A. | 元素 A、B 组成的化合物常温下一定呈气态 | |
| B. | 元素 D 的最高价氧化物对应的水化物不是两性化合物 | |
| C. | 元素 C 的最高价氧化物对应的水化物是弱碱 | |
| D. | 化合物 AE 与 CE 有相同类型的化学键 |
8.某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:
①给试管加热 ②加入铁粉 ③加入冰块
④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,
能加快反应速率的是( )
①给试管加热 ②加入铁粉 ③加入冰块
④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,
能加快反应速率的是( )
| A. | ①②⑤ | B. | ①② | C. | ③④ | D. | ③④⑤ |
5.在反应 3NO2+H2O→2HNO3+NO 中NO2的作用是( )
| A. | 氧化剂 | B. | 还原剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
12.下列变化中,可逆性最不明显的是( )
| A. | NH3+H2O→NH3•H2O | B. | H2+I2→2HI | ||
| C. | HClO→H++ClO- | D. | Cl2+2NaOH→NaCl+NaClO+H2O |
9.下列物质中,含有极性共价键的离子化合物是( )
| A. | MgO | B. | NaCl | C. | NaOH | D. | H2O2 |
6.如图为铜-锌-稀硫酸构成的原电池示意图,下列说法正确的是( )
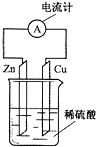

| A. | 锌片为正极,且锌片逐渐溶解 | B. | 铜片为负极,且铜片上有气泡 | ||
| C. | 溶液中的H+移向铜极 | D. | 该装置能将电能转变为化学能 |
7.下列表述正确的是( )
| A. | CO2的比例模型: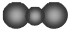 | |
| B. | 氢化铵(NH4H)电子式: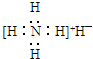 | |
| C. | (CH3)3COH的名称:2,2-二甲基乙醇 | |
| D. | 乙酸乙酯的水解CH3COOCH2CH3+H218O $?_{△}^{酸}$CH3CO18OH+CH3CH2OH |
