题目内容
8.某同学在试管中做铁钉与稀硫酸反应的实验,发现反应速率较慢,下列措施:①给试管加热 ②加入铁粉 ③加入冰块
④加入少量醋酸钠晶体 ⑤将稀硫酸换为浓硫酸,
能加快反应速率的是( )
| A. | ①②⑤ | B. | ①② | C. | ③④ | D. | ③④⑤ |
分析 对于铁与稀硫酸的反应,增大固体表面积、适当增大硫酸浓度或升高反应温度以及形成原电池反应都可增大反应速率,以此解答该题.
解答 解:①给试管加热,温度升高反应速率加快,故正确;
②加入铁粉,增大了反应物的接触面积,反应速率加快,故正确;
③加入冰块,降低了温度并使稀硫酸浓度降低,反应速率减慢,故错误;
④加入少量醋酸钠晶体,醋酸钠能够与硫酸反应生成醋酸,降低了氢离子浓度,反应速率减慢,故错误;
⑤将稀硫酸换为浓硫酸,浓硫酸能够使铁钝化,不能生成氢气,故错误;
能够加快反应速率的有①②,故选B.
点评 本题考查化学反应速率知识,侧重于学生的基本知识的考查,注意把握常见影响化学反应速率的因素,注重基础知识的积累,难度不大.

练习册系列答案
相关题目
19.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: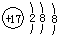 | B. | CH4分子的球棍模型: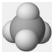 | ||
| C. | 氯化镁的电子式: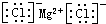 | D. | N2的结构式: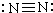 |
16.下表是元素周期表中短周期元素部分,表中字母分别代表一种元素:
(1)上述化学性质最不活泼的元素是氦(填元素名称).
(2)画出h的原子结构示意图 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
| a | b | ||||||
| e | f | g | |||||
| c | d | h | i | j | |||
(2)画出h的原子结构示意图
 ,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,其单质在电子工业上有重要用途,写出工业制取该单质的化学方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.(3)c、d、g离子半径由小到大的顺序是O2->Na+>Al3+ (用离子符号表示).
(4)表中元素g的氢化物稳定性>(填“>”或“<”)元素e的氢化物稳定性.
(5)c元素最高价氧化物的水化物中含有离子键、共价键(填化学键类型),该物质不能储存在带玻璃塞的试剂瓶中的原因:SiO2+2NaOH=Na2SiO3+H2O(用化学方程式表示).
13.下列各组物质可以直接通过分液进行分离的组合是( )
①苯和水;
②乙酸乙酯和乙醇;
③乙酸乙酯和纯碱溶液;
④苯和溴苯;
⑤硝基苯和水;
⑥蔗糖与葡萄糖.
①苯和水;
②乙酸乙酯和乙醇;
③乙酸乙酯和纯碱溶液;
④苯和溴苯;
⑤硝基苯和水;
⑥蔗糖与葡萄糖.
| A. | ①③⑤ | B. | ①④⑤⑥ | C. | ①②③ | D. | ②③⑤ |
20.如图所示Cu-Zn原电池,下列叙述正确的是( )
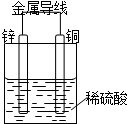

| A. | 锌为负极,发生氧化反应 | B. | 铜为负极,铜片上有气泡产生 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 溶液中的SO42-移向正极 |
18.下列有关问题,与盐的水解无关的是( )
| A. | 用盐酸除铁锈 | |
| B. | 用纯碱溶液清洗油污 | |
| C. | 加热蒸干AlCl3溶液得到Al(OH)3固体 | |
| D. | 实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |